ກະວີ:
Sara Rhodes
ວັນທີຂອງການສ້າງ:
12 ກຸມພາ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
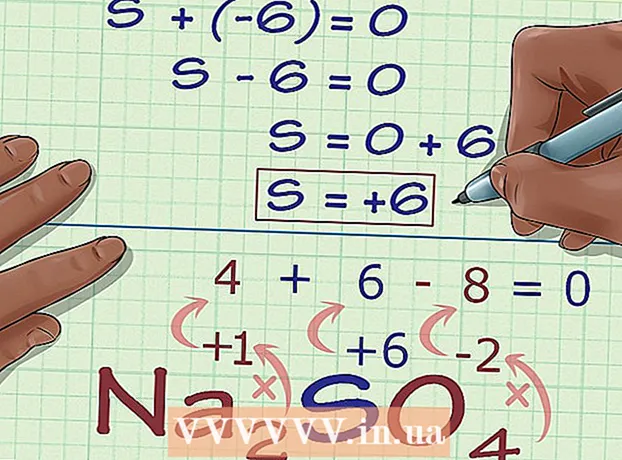
ເນື້ອຫາ
- ຂັ້ນຕອນ
- ສ່ວນທີ 1 ຂອງ 2: ການກໍານົດສະພາບຜຸພັງຕາມກົດofາຍຂອງເຄມີສາດ
- ພາກທີ 2 ຂອງ 2: ການກໍານົດສະພາບການຜຸພັງໂດຍບໍ່ໃຊ້ກົດofາຍຂອງເຄມີສາດ
- ຄໍາແນະນໍາ
- ເຈົ້າຕ້ອງການຫຍັງ
ໃນເຄມີສາດ, ຄໍາວ່າ "ການຜຸພັງ" ແລະ "ການຫຼຸດຜ່ອນ" meanາຍເຖິງປະຕິກິລິຍາທີ່ປະລໍາມະນູຫຼືກຸ່ມຂອງປະລໍາມະນູເສຍຫຼືຕາມລໍາດັບໄດ້ຮັບເອເລັກໂຕຣນິກ. ສະພາບການຜຸພັງແມ່ນຄ່າຕົວເລກທີ່ມອບໃຫ້ ໜຶ່ງ ຫຼືຫຼາຍກວ່າປະລໍາມະນູທີ່ເປັນຕົວເລກຂອງຈໍານວນເອເລັກໂຕຣນິກທີ່ແຈກຢາຍຄືນແລະສະແດງໃຫ້ເຫັນວ່າເອເລັກໂຕຣນິກເຫຼົ່ານີ້ຖືກແຈກຢາຍລະຫວ່າງປະລໍາມະນູໃນລະຫວ່າງປະຕິກິລິຍາແນວໃດ. ການ ກຳ ນົດຄ່ານີ້ສາມາດເປັນທັງຂັ້ນຕອນງ່າຍດາຍແລະຂ້ອນຂ້າງສັບສົນ, ຂຶ້ນກັບປະລໍາມະນູແລະໂມເລກຸນທີ່ປະກອບດ້ວຍພວກມັນ. ຍິ່ງໄປກວ່ານັ້ນ, ປະລໍາມະນູຂອງບາງອົງປະກອບສາມາດມີສະຖານະການຜຸພັງຫຼາຍອັນ. ໂຊກດີ, ມີກົດລະບຽບທີ່ບໍ່ແນ່ນອນງ່າຍ simple ສຳ ລັບການ ກຳ ນົດສະຖານະການຜຸພັງ, ເພື່ອຄວາມuseັ້ນໃຈໃນການ ນຳ ໃຊ້ເຊິ່ງມັນພຽງພໍທີ່ຈະຮູ້ພື້ນຖານຂອງເຄມີສາດແລະພຶດຊະຄະນິດ.
ຂັ້ນຕອນ
ສ່ວນທີ 1 ຂອງ 2: ການກໍານົດສະພາບຜຸພັງຕາມກົດofາຍຂອງເຄມີສາດ
 1 ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມມີສ່ວນປະກອບຢູ່ຫຼືບໍ່. ສະພາບການຜຸພັງຂອງອາຕອມຢູ່ນອກທາດເຄມີແມ່ນສູນ. ກົດລະບຽບນີ້ແມ່ນເປັນຄວາມຈິງທັງສອງຢ່າງສໍາລັບສານທີ່ສ້າງຂຶ້ນມາຈາກອະຕອມທີ່ບໍ່ໄດ້ແຍກອອກຈາກກັນ, ແລະສໍາລັບສິ່ງທີ່ປະກອບດ້ວຍໂມເລກຸນ polyatomic ສອງອັນ, ຫຼືອົງປະກອບ ໜຶ່ງ.
1 ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມມີສ່ວນປະກອບຢູ່ຫຼືບໍ່. ສະພາບການຜຸພັງຂອງອາຕອມຢູ່ນອກທາດເຄມີແມ່ນສູນ. ກົດລະບຽບນີ້ແມ່ນເປັນຄວາມຈິງທັງສອງຢ່າງສໍາລັບສານທີ່ສ້າງຂຶ້ນມາຈາກອະຕອມທີ່ບໍ່ໄດ້ແຍກອອກຈາກກັນ, ແລະສໍາລັບສິ່ງທີ່ປະກອບດ້ວຍໂມເລກຸນ polyatomic ສອງອັນ, ຫຼືອົງປະກອບ ໜຶ່ງ. - ຕົວຢ່າງ, Al(s) ແລະ Cl2 ມີສະຖານະການຜຸພັງ 0, ເນື່ອງຈາກທັງສອງຢູ່ໃນສະພາບທາດທີ່ບໍ່ມີການຜູກມັດທາງເຄມີ.
- ໃຫ້ສັງເກດວ່າຮູບແບບ allotropic ຂອງກໍາມະຖັນ S8, ຫຼື octacera, ເຖິງວ່າຈະມີໂຄງສ້າງທີ່ບໍ່ ທຳ ມະດາ, ກໍ່ຍັງມີລັກສະນະເປັນສະຖານະການຜຸພັງທີ່ບໍ່ມີສູນ.
 2 ກວດເບິ່ງວ່າສານທີ່ຢູ່ໃນຄໍາຖາມປະກອບດ້ວຍໄອອອນ. ສະພາບການຜຸພັງຂອງໄອອອນແມ່ນເທົ່າກັບການສາກຂອງມັນ. ອັນນີ້ແມ່ນຄວາມຈິງທັງສໍາລັບທາດໄອອອນຟຣີແລະສໍາລັບທາດທີ່ເປັນສ່ວນປະກອບຂອງສານເຄມີ.
2 ກວດເບິ່ງວ່າສານທີ່ຢູ່ໃນຄໍາຖາມປະກອບດ້ວຍໄອອອນ. ສະພາບການຜຸພັງຂອງໄອອອນແມ່ນເທົ່າກັບການສາກຂອງມັນ. ອັນນີ້ແມ່ນຄວາມຈິງທັງສໍາລັບທາດໄອອອນຟຣີແລະສໍາລັບທາດທີ່ເປັນສ່ວນປະກອບຂອງສານເຄມີ. - ຕົວຢ່າງ, ສະພາບການຜຸພັງຂອງ Cl ion ແມ່ນ -1.
- ສະພາບການຜຸພັງຂອງທາດ Cl ion ໃນທາດປະສົມເຄມີ NaCl ແມ່ນ -1 ເຊັ່ນກັນ. ເນື່ອງຈາກ Na ion, ຕາມນິຍາມ, ມີຄ່າຂອງ +1, ພວກເຮົາສະຫຼຸບໄດ້ວ່າຄ່າຂອງ Cl ion ແມ່ນ -1, ແລະດັ່ງນັ້ນສະພາບການຜຸພັງຂອງມັນແມ່ນ -1.
 3 ກະລຸນາຮັບຊາບວ່າໄອອອນໂລຫະສາມາດມີສະຖານະການຜຸພັງຫຼາຍອັນ. ປະລໍາມະນູຂອງອົງປະກອບໂລຫະຫຼາຍຊະນິດສາມາດ ionize ປະລິມານທີ່ແຕກຕ່າງກັນ. ຕົວຢ່າງ, ການຮັບຜິດຊອບທາດ ion ຂອງໂລຫະເຊັ່ນເຫຼັກ (Fe) ແມ່ນ +2 ຫຼື +3. ຄວາມສາມາດຮັບຜິດຊອບຂອງໄອອອນໂລຫະ (ແລະສະພາບການຜຸພັງຂອງມັນ) ສາມາດຖືກກໍານົດໂດຍການຄິດຄ່າຂອງທາດໄອອອນຂອງອົງປະກອບອື່ນ with ທີ່ໂລຫະນີ້ເປັນສ່ວນປະກອບຂອງສານເຄມີ; ຢູ່ໃນຂໍ້ຄວາມ, ຄ່ານີ້ແມ່ນສະແດງໂດຍຕົວເລກຂອງໂຣມັນ: ຕົວຢ່າງ, ທາດເຫຼັກ (III) ມີສະພາບການຜຸພັງຂອງ +3.
3 ກະລຸນາຮັບຊາບວ່າໄອອອນໂລຫະສາມາດມີສະຖານະການຜຸພັງຫຼາຍອັນ. ປະລໍາມະນູຂອງອົງປະກອບໂລຫະຫຼາຍຊະນິດສາມາດ ionize ປະລິມານທີ່ແຕກຕ່າງກັນ. ຕົວຢ່າງ, ການຮັບຜິດຊອບທາດ ion ຂອງໂລຫະເຊັ່ນເຫຼັກ (Fe) ແມ່ນ +2 ຫຼື +3. ຄວາມສາມາດຮັບຜິດຊອບຂອງໄອອອນໂລຫະ (ແລະສະພາບການຜຸພັງຂອງມັນ) ສາມາດຖືກກໍານົດໂດຍການຄິດຄ່າຂອງທາດໄອອອນຂອງອົງປະກອບອື່ນ with ທີ່ໂລຫະນີ້ເປັນສ່ວນປະກອບຂອງສານເຄມີ; ຢູ່ໃນຂໍ້ຄວາມ, ຄ່ານີ້ແມ່ນສະແດງໂດຍຕົວເລກຂອງໂຣມັນ: ຕົວຢ່າງ, ທາດເຫຼັກ (III) ມີສະພາບການຜຸພັງຂອງ +3. - ເປັນຕົວຢ່າງ, ພິຈາລະນາທາດປະສົມທີ່ມີທາດອາລູມິນຽມ. ການຄິດໄລ່ທັງofົດຂອງທາດປະສົມ AlCl3 ແມ່ນສູນ.ເນື່ອງຈາກວ່າພວກເຮົາຮູ້ວ່າ Cl ions ມີຄ່າຂອງ -1, ແລະທາດປະກອບມີ 3 ions ດັ່ງກ່າວ, ສໍາລັບຄວາມເປັນກາງທົ່ວໄປຂອງສານທີ່ຢູ່ໃນຄໍາຖາມ, Al ion ຈະຕ້ອງມີຄ່າຂອງ +3. ດັ່ງນັ້ນ, ໃນກໍລະນີນີ້, ສະພາບການຜຸພັງຂອງອາລູມີນຽມແມ່ນ +3.
 4 ສະພາບການຜຸພັງຂອງອົກຊີແມ່ນ -2 (ມີຂໍ້ຍົກເວັ້ນບາງອັນ). ໃນເກືອບທຸກກໍລະນີ, ປະລໍາມະນູອົກຊີເຈນທີ່ມີສະພາບການຜຸພັງຂອງ -2. ມີຂໍ້ຍົກເວັ້ນຫຼາຍອັນຕໍ່ກັບກົດລະບຽບນີ້:
4 ສະພາບການຜຸພັງຂອງອົກຊີແມ່ນ -2 (ມີຂໍ້ຍົກເວັ້ນບາງອັນ). ໃນເກືອບທຸກກໍລະນີ, ປະລໍາມະນູອົກຊີເຈນທີ່ມີສະພາບການຜຸພັງຂອງ -2. ມີຂໍ້ຍົກເວັ້ນຫຼາຍອັນຕໍ່ກັບກົດລະບຽບນີ້: - ຖ້າອົກຊີຢູ່ໃນສະພາບອົງປະກອບ (O2), ສະພາບການຜຸພັງຂອງມັນແມ່ນ 0, ຄືກັບໃນກໍລະນີຂອງສານປະຖົມອື່ນ.
- ຖ້າອົກຊີເປັນສ່ວນ ໜຶ່ງ ຂອງ ເປີອອກໄຊ, ສະພາບຜຸພັງຂອງມັນແມ່ນ -1. Peroxides ແມ່ນກຸ່ມຂອງທາດປະກອບທີ່ບັນຈຸພັນທະບັດອົກຊີແຊນ-ອົກຊີແຊນງ່າຍ simple (ເຊັ່ນ: ທາດປະສົມ peroxide anion O2). ສໍາລັບຕົວຢ່າງ, ໃນອົງປະກອບຂອງ H ໄດ້2ໂອ2 (hydrogen peroxide) ອົກຊີເຈນທີ່ມີຄ່າແລະສະຖານະການຜຸພັງຂອງ -1.
- ເມື່ອປະສົມປະສານກັບ fluorine, ອົກຊີເຈນມີສະພາບການຜຸພັງຂອງ +2, ອ່ານກົດລະບຽບສໍາລັບ fluorine ຢູ່ລຸ່ມນີ້.
 5 ໄຮໂດເຈນມີສະພາບການຜຸພັງຢູ່ທີ່ +1, ມີຂໍ້ຍົກເວັ້ນບາງອັນ. ເຊັ່ນດຽວກັນກັບອົກຊີ, ຍັງມີຂໍ້ຍົກເວັ້ນ. ຕາມກົດລະບຽບ, ສະພາບການຜຸພັງຂອງໄຮໂດເຈນແມ່ນ +1 (ຖ້າມັນບໍ່ຢູ່ໃນສະພາບອົງປະກອບ H2). ແນວໃດກໍ່ຕາມ, ຢູ່ໃນທາດປະສົມທີ່ເອີ້ນວ່າໄຮໂດຣໄຊ, ສະພາບການຜຸພັງຂອງໄຮໂດເຈນແມ່ນ -1.
5 ໄຮໂດເຈນມີສະພາບການຜຸພັງຢູ່ທີ່ +1, ມີຂໍ້ຍົກເວັ້ນບາງອັນ. ເຊັ່ນດຽວກັນກັບອົກຊີ, ຍັງມີຂໍ້ຍົກເວັ້ນ. ຕາມກົດລະບຽບ, ສະພາບການຜຸພັງຂອງໄຮໂດເຈນແມ່ນ +1 (ຖ້າມັນບໍ່ຢູ່ໃນສະພາບອົງປະກອບ H2). ແນວໃດກໍ່ຕາມ, ຢູ່ໃນທາດປະສົມທີ່ເອີ້ນວ່າໄຮໂດຣໄຊ, ສະພາບການຜຸພັງຂອງໄຮໂດເຈນແມ່ນ -1. - ຕົວຢ່າງ, ໃນ H.2O ສະພາບການຜຸພັງຂອງໄຮໂດເຈນແມ່ນ +1 ເພາະວ່າປະລໍາມະນູອົກຊີເຈນມີຄ່າຮັບ -2, ແລະຕ້ອງຄິດຄ່າສອງ +1 ຕື່ມອີກສໍາລັບຄວາມເປັນກາງທັງົດ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ໃນອົງປະກອບຂອງ sodium hydride, ສະພາບການຜຸພັງຂອງ hydrogen ແມ່ນ -1 ຢູ່ແລ້ວ, ເນື່ອງຈາກ Na ion ມີຄວາມຮັບຜິດຊອບຂອງ +1, ແລະສໍາລັບການໃຊ້ໄຟຟ້າທົ່ວໄປ, ຄ່າຂອງອະຕອມໄຮໂດເຈນ (ແລະດັ່ງນັ້ນສະພາບການຜຸພັງຂອງມັນ) ຄວນ ຈະ -1.
 6 ຟລໍຣີນ ສະເີ ມີສະຖານະການຜຸພັງຂອງ -1. ດັ່ງທີ່ໄດ້ລະບຸໄວ້ແລ້ວ, ສະພາບການຜຸພັງຂອງບາງອົງປະກອບ (ໄອອອນໂລຫະ, ປະລໍາມະນູອົກຊີໃນ peroxides, ແລະອື່ນ on) ສາມາດແຕກຕ່າງກັນໄປຕາມຫຼາຍປັດໃຈ. ແນວໃດກໍ່ຕາມ, ສະຖານະການຜຸພັງຂອງ fluorine ແມ່ນບໍ່ປ່ຽນແປງ -1. ອັນນີ້ແມ່ນເນື່ອງມາຈາກຄວາມຈິງທີ່ວ່າອົງປະກອບນີ້ມີ electronegativity ທີ່ຍິ່ງໃຫຍ່ທີ່ສຸດ - ເວົ້າອີກຢ່າງ ໜຶ່ງ, ປະລໍາມະນູ fluorine ແມ່ນມີຄວາມເຕັມໃຈ ໜ້ອຍ ທີ່ສຸດທີ່ຈະເຂົ້າຮ່ວມກັບເອເລັກໂຕຣນິກຂອງຕົນເອງແລະດຶງດູດເອົາເອເລັກໂຕຣນິກຕ່າງປະເທດຢ່າງຈິງຈັງ. ດັ່ງນັ້ນ, ຄ່າບໍລິການຂອງເຂົາເຈົ້າຍັງບໍ່ປ່ຽນແປງ.
6 ຟລໍຣີນ ສະເີ ມີສະຖານະການຜຸພັງຂອງ -1. ດັ່ງທີ່ໄດ້ລະບຸໄວ້ແລ້ວ, ສະພາບການຜຸພັງຂອງບາງອົງປະກອບ (ໄອອອນໂລຫະ, ປະລໍາມະນູອົກຊີໃນ peroxides, ແລະອື່ນ on) ສາມາດແຕກຕ່າງກັນໄປຕາມຫຼາຍປັດໃຈ. ແນວໃດກໍ່ຕາມ, ສະຖານະການຜຸພັງຂອງ fluorine ແມ່ນບໍ່ປ່ຽນແປງ -1. ອັນນີ້ແມ່ນເນື່ອງມາຈາກຄວາມຈິງທີ່ວ່າອົງປະກອບນີ້ມີ electronegativity ທີ່ຍິ່ງໃຫຍ່ທີ່ສຸດ - ເວົ້າອີກຢ່າງ ໜຶ່ງ, ປະລໍາມະນູ fluorine ແມ່ນມີຄວາມເຕັມໃຈ ໜ້ອຍ ທີ່ສຸດທີ່ຈະເຂົ້າຮ່ວມກັບເອເລັກໂຕຣນິກຂອງຕົນເອງແລະດຶງດູດເອົາເອເລັກໂຕຣນິກຕ່າງປະເທດຢ່າງຈິງຈັງ. ດັ່ງນັ້ນ, ຄ່າບໍລິການຂອງເຂົາເຈົ້າຍັງບໍ່ປ່ຽນແປງ.  7 ຜົນລວມຂອງສະຖານະການຜຸພັງໃນທາດປະສົມເທົ່າກັບຄວາມສາມາດຂອງມັນ. ສະຖານະການຜຸພັງຂອງອະຕອມທັງthatົດທີ່ປະກອບເປັນສານປະກອບທາງເຄມີຄວນຕື່ມໃສ່ກັບຄວາມຮັບຜິດຊອບຂອງທາດປະສົມນີ້. ຕົວຢ່າງ, ຖ້າທາດປະສົມເປັນກາງ, ຜົນລວມຂອງສະພາບການຜຸພັງຂອງອະຕອມທັງitsົດຂອງມັນຄວນຈະເປັນສູນ; ຖ້າທາດປະສົມເປັນທາດໂພລີຕຽມທີ່ມີຄ່າຂອງ -1, ຜົນລວມຂອງສະພາວະການຜຸພັງແມ່ນ -1, ແລະອື່ນ on.
7 ຜົນລວມຂອງສະຖານະການຜຸພັງໃນທາດປະສົມເທົ່າກັບຄວາມສາມາດຂອງມັນ. ສະຖານະການຜຸພັງຂອງອະຕອມທັງthatົດທີ່ປະກອບເປັນສານປະກອບທາງເຄມີຄວນຕື່ມໃສ່ກັບຄວາມຮັບຜິດຊອບຂອງທາດປະສົມນີ້. ຕົວຢ່າງ, ຖ້າທາດປະສົມເປັນກາງ, ຜົນລວມຂອງສະພາບການຜຸພັງຂອງອະຕອມທັງitsົດຂອງມັນຄວນຈະເປັນສູນ; ຖ້າທາດປະສົມເປັນທາດໂພລີຕຽມທີ່ມີຄ່າຂອງ -1, ຜົນລວມຂອງສະພາວະການຜຸພັງແມ່ນ -1, ແລະອື່ນ on. - ນີ້ແມ່ນວິທີການທົດສອບທີ່ດີ - ຖ້າຜົນລວມຂອງສະພາບການຜຸພັງບໍ່ເທົ່າກັບການຄິດໄລ່ທັງofົດຂອງທາດປະສົມ, ສະນັ້ນເຈົ້າຄິດຜິດບ່ອນໃດບ່ອນນຶ່ງ.
ພາກທີ 2 ຂອງ 2: ການກໍານົດສະພາບການຜຸພັງໂດຍບໍ່ໃຊ້ກົດofາຍຂອງເຄມີສາດ
 1 ຊອກຫາອະຕອມທີ່ບໍ່ມີກົດລະບຽບທີ່ເຄັ່ງຄັດກ່ຽວກັບສະພາບຜຸພັງຂອງມັນ. ສໍາລັບບາງອົງປະກອບ, ບໍ່ມີກົດລະບຽບທີ່ຕັ້ງໄວ້ຢ່າງ ໜັກ ແໜ້ນ ເພື່ອຊອກຫາສະພາບການຜຸພັງ. ຖ້າອະຕອມບໍ່ເຂົ້າກັບກົດເກນໃດ ໜຶ່ງ ທີ່ໄດ້ລະບຸໄວ້ຂ້າງເທິງ, ແລະເຈົ້າບໍ່ຮູ້ຄ່າຂອງມັນ (ຕົວຢ່າງ, ອະຕອມເປັນສ່ວນ ໜຶ່ງ ຂອງຊັບຊ້ອນ, ແລະຄ່າຂອງມັນບໍ່ໄດ້ລະບຸໄວ້), ເຈົ້າສາມາດກໍານົດສະຖານະການຜຸພັງຂອງອະຕອມດັ່ງກ່າວ ໂດຍການຍົກເວັ້ນ. ທຳ ອິດ, ກຳ ນົດຄ່າຂອງອະຕອມອື່ນ other ທັງinົດໃນທາດປະສົມ, ແລະຈາກນັ້ນ, ຈາກການຄິດຄ່າທັງofົດຂອງທາດປະສົມ, ຄິດໄລ່ສະພາບການຜຸພັງຂອງອະຕອມນີ້.
1 ຊອກຫາອະຕອມທີ່ບໍ່ມີກົດລະບຽບທີ່ເຄັ່ງຄັດກ່ຽວກັບສະພາບຜຸພັງຂອງມັນ. ສໍາລັບບາງອົງປະກອບ, ບໍ່ມີກົດລະບຽບທີ່ຕັ້ງໄວ້ຢ່າງ ໜັກ ແໜ້ນ ເພື່ອຊອກຫາສະພາບການຜຸພັງ. ຖ້າອະຕອມບໍ່ເຂົ້າກັບກົດເກນໃດ ໜຶ່ງ ທີ່ໄດ້ລະບຸໄວ້ຂ້າງເທິງ, ແລະເຈົ້າບໍ່ຮູ້ຄ່າຂອງມັນ (ຕົວຢ່າງ, ອະຕອມເປັນສ່ວນ ໜຶ່ງ ຂອງຊັບຊ້ອນ, ແລະຄ່າຂອງມັນບໍ່ໄດ້ລະບຸໄວ້), ເຈົ້າສາມາດກໍານົດສະຖານະການຜຸພັງຂອງອະຕອມດັ່ງກ່າວ ໂດຍການຍົກເວັ້ນ. ທຳ ອິດ, ກຳ ນົດຄ່າຂອງອະຕອມອື່ນ other ທັງinົດໃນທາດປະສົມ, ແລະຈາກນັ້ນ, ຈາກການຄິດຄ່າທັງofົດຂອງທາດປະສົມ, ຄິດໄລ່ສະພາບການຜຸພັງຂອງອະຕອມນີ້. - ຕົວຢ່າງ, ຢູ່ໃນທາດປະສົມ Na2ດັ່ງນັ້ນ4 ບໍ່ຮູ້ຈັກຄ່າຂອງປະລໍາມະນູກໍາມະຖັນ (S) - ພວກເຮົາຮູ້ພຽງແຕ່ວ່າມັນບໍ່ແມ່ນສູນ, ເນື່ອງຈາກກໍາມະຖັນບໍ່ໄດ້ຢູ່ໃນສະພາບປະຖົມ. ທາດປະສົມນີ້ໃຊ້ເປັນຕົວຢ່າງທີ່ດີເພື່ອສະແດງໃຫ້ເຫັນວິທີການພຶດຊະຄະນິດເພື່ອກໍານົດສະພາບການຜຸພັງ.
 2 ຊອກຫາສະພາບການຜຸພັງຂອງອົງປະກອບທີ່ຍັງເຫຼືອຢູ່ໃນທາດປະສົມ. ການນໍາໃຊ້ກົດລະບຽບທີ່ໄດ້ອະທິບາຍຂ້າງເທິງ, ກໍານົດສະຖານະການຜຸພັງຂອງອະຕອມທີ່ຍັງເຫຼືອຂອງທາດປະສົມ. ຢ່າລືມກ່ຽວກັບຂໍ້ຍົກເວັ້ນຕໍ່ກັບກົດ O, H, ແລະອື່ນ on.
2 ຊອກຫາສະພາບການຜຸພັງຂອງອົງປະກອບທີ່ຍັງເຫຼືອຢູ່ໃນທາດປະສົມ. ການນໍາໃຊ້ກົດລະບຽບທີ່ໄດ້ອະທິບາຍຂ້າງເທິງ, ກໍານົດສະຖານະການຜຸພັງຂອງອະຕອມທີ່ຍັງເຫຼືອຂອງທາດປະສົມ. ຢ່າລືມກ່ຽວກັບຂໍ້ຍົກເວັ້ນຕໍ່ກັບກົດ O, H, ແລະອື່ນ on. - ສໍາລັບ Na2ດັ່ງນັ້ນ4, ໂດຍນໍາໃຊ້ກົດລະບຽບຂອງພວກເຮົາ, ພວກເຮົາພົບວ່າການສາກ (ແລະສະນັ້ນສະພາບການຜຸພັງ) ຂອງ Na ion ແມ່ນ +1, ແລະສໍາລັບແຕ່ລະປະລໍາມະນູອົກຊີເຈນແມ່ນ -2.
 3 ຄູນ ຈຳ ນວນອະຕອມໂດຍສະຖານະການຜຸພັງຂອງມັນ. ດຽວນີ້ພວກເຮົາຮູ້ສະຖານະການຜຸພັງຂອງອະຕອມທັງexceptົດຍົກເວັ້ນອັນດຽວ, ມັນ ຈຳ ເປັນຕ້ອງ ຄຳ ນຶງວ່າອາດຈະມີຫຼາຍປະລໍາມະນູຂອງບາງອົງປະກອບ. ຄູນ ຈຳ ນວນອະຕອມຂອງແຕ່ລະອົງປະກອບ (ມັນໄດ້ຖືກຊີ້ບອກໃນສູດເຄມີຂອງທາດປະສົມເປັນຕົວຫ້ອຍຕາມສັນຍາລັກຂອງອົງປະກອບ) ໂດຍສະຖານະການຜຸພັງຂອງມັນ.
3 ຄູນ ຈຳ ນວນອະຕອມໂດຍສະຖານະການຜຸພັງຂອງມັນ. ດຽວນີ້ພວກເຮົາຮູ້ສະຖານະການຜຸພັງຂອງອະຕອມທັງexceptົດຍົກເວັ້ນອັນດຽວ, ມັນ ຈຳ ເປັນຕ້ອງ ຄຳ ນຶງວ່າອາດຈະມີຫຼາຍປະລໍາມະນູຂອງບາງອົງປະກອບ. ຄູນ ຈຳ ນວນອະຕອມຂອງແຕ່ລະອົງປະກອບ (ມັນໄດ້ຖືກຊີ້ບອກໃນສູດເຄມີຂອງທາດປະສົມເປັນຕົວຫ້ອຍຕາມສັນຍາລັກຂອງອົງປະກອບ) ໂດຍສະຖານະການຜຸພັງຂອງມັນ. - ຢູ່ນາ2ດັ່ງນັ້ນ4 ພວກເຮົາມີ 2 ປະລໍາມະນູ Na ແລະ 4 ປະລໍາມະນູ O.
 4 ເພີ່ມຜົນໄດ້ຮັບທີ່ຜ່ານມາ. ສະຫຼຸບຜົນໄດ້ຮັບຂອງການຄູນ, ພວກເຮົາໄດ້ຮັບສະຖານະການຜຸພັງຂອງທາດປະສົມ ໂດຍບໍ່ມີການ ຄຳ ນຶງເຖິງການປະກອບສ່ວນຂອງອະຕອມທີ່ຕ້ອງການ.
4 ເພີ່ມຜົນໄດ້ຮັບທີ່ຜ່ານມາ. ສະຫຼຸບຜົນໄດ້ຮັບຂອງການຄູນ, ພວກເຮົາໄດ້ຮັບສະຖານະການຜຸພັງຂອງທາດປະສົມ ໂດຍບໍ່ມີການ ຄຳ ນຶງເຖິງການປະກອບສ່ວນຂອງອະຕອມທີ່ຕ້ອງການ. - ໃນຕົວຢ່າງຂອງພວກເຮົາ, ສໍາລັບ Na2ດັ່ງນັ້ນ4 ພວກເຮົາເພີ່ມ 2 ແລະ -8 ແລະໄດ້ -6.
 5 ຊອກຫາສະຖານະການຜຸພັງທີ່ບໍ່ຮູ້ຈັກຈາກຄ່າຂອງທາດປະສົມ. ດຽວນີ້ເຈົ້າມີຂໍ້ມູນທັງtoົດເພື່ອ ຄຳ ນວນສະຖານະການຜຸພັງທີ່ຕ້ອງການໄດ້ຢ່າງງ່າຍດາຍ. ຂຽນສົມຜົນ, ຢູ່ເບື້ອງຊ້າຍເຊິ່ງຈະມີຜົນລວມຂອງຕົວເລກທີ່ໄດ້ມາໃນຂັ້ນຕອນການຄິດໄລ່ກ່ອນ ໜ້າ ແລະສະຖານະການຜຸພັງທີ່ບໍ່ຮູ້ຈັກ, ແລະຢູ່ເບື້ອງຂວາຂອງຄ່າທັງofົດຂອງທາດປະສົມ. ໃນຄໍາສັບຕ່າງອື່ນ, (ຜົນລວມຂອງສະພາບການຜຸພັງທີ່ຮູ້ຈັກ) + (ສະຖານະການຜຸພັງທີ່ຕ້ອງການ) = (ການຄິດໄລ່ທາດປະສົມ).
5 ຊອກຫາສະຖານະການຜຸພັງທີ່ບໍ່ຮູ້ຈັກຈາກຄ່າຂອງທາດປະສົມ. ດຽວນີ້ເຈົ້າມີຂໍ້ມູນທັງtoົດເພື່ອ ຄຳ ນວນສະຖານະການຜຸພັງທີ່ຕ້ອງການໄດ້ຢ່າງງ່າຍດາຍ. ຂຽນສົມຜົນ, ຢູ່ເບື້ອງຊ້າຍເຊິ່ງຈະມີຜົນລວມຂອງຕົວເລກທີ່ໄດ້ມາໃນຂັ້ນຕອນການຄິດໄລ່ກ່ອນ ໜ້າ ແລະສະຖານະການຜຸພັງທີ່ບໍ່ຮູ້ຈັກ, ແລະຢູ່ເບື້ອງຂວາຂອງຄ່າທັງofົດຂອງທາດປະສົມ. ໃນຄໍາສັບຕ່າງອື່ນ, (ຜົນລວມຂອງສະພາບການຜຸພັງທີ່ຮູ້ຈັກ) + (ສະຖານະການຜຸພັງທີ່ຕ້ອງການ) = (ການຄິດໄລ່ທາດປະສົມ).- ໃນກໍລະນີຂອງພວກເຮົາ, Na2ດັ່ງນັ້ນ4 ການແກ້ໄຂຄືແນວນີ້:
- (ຜົນລວມຂອງສະພາບການຜຸພັງທີ່ຮູ້ຈັກ) + (ສະຖານະການຜຸພັງທີ່ຕ້ອງການ) = (ຄ່າປະສົມ)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2ດັ່ງນັ້ນ4 ຊູນຟູຣິກມີສະພາບຜຸພັງ 6.
- ໃນກໍລະນີຂອງພວກເຮົາ, Na2ດັ່ງນັ້ນ4 ການແກ້ໄຂຄືແນວນີ້:
ຄໍາແນະນໍາ
- ຢູ່ໃນທາດປະສົມ, ຜົນລວມຂອງສະຖານະການຜຸພັງທັງmustົດຈະຕ້ອງເທົ່າກັບການຮັບຜິດຊອບ. ຍົກຕົວຢ່າງ, ຖ້າທາດປະສົມແມ່ນທາດ ion diatomic, ຜົນລວມຂອງສະຖານະການຜຸພັງຂອງອະຕອມຈະຕ້ອງເທົ່າກັບການສາກ ionic ທັງົດ.
- ມັນມີປະໂຫຍດຫຼາຍທີ່ຈະສາມາດໃຊ້ຕາຕະລາງແຕ່ລະໄລຍະແລະຮູ້ບ່ອນທີ່ມີອົງປະກອບໂລຫະແລະໂລຫະບໍ່ຢູ່ໃນນັ້ນ.
- ສະພາບການຜຸພັງຂອງອະຕອມໃນຮູບແບບປະຖົມແມ່ນເປັນສູນສະເີ. ສະພາບການຜຸພັງຂອງໄອອອນດ່ຽວແມ່ນເທົ່າກັບການສາກຂອງມັນ. ອົງປະກອບຂອງກຸ່ມ 1A ຂອງຕາຕະລາງແຕ່ລະໄລຍະ, ເຊັ່ນ: ໄຮໂດເຈນ, ລິທຽມ, ໂຊດຽມ, ໃນຮູບແບບອົງປະກອບມີສະພາບການຜຸພັງຂອງ +1; ສະພາບການຜຸພັງຂອງໂລຫະກຸ່ມ 2A, ເຊັ່ນ: ແມກນີຊຽມແລະແຄວຊຽມ, ແມ່ນ +2 ໃນຮູບແບບອົງປະກອບ. ອົກຊີເຈນແລະໄຮໂດເຈນ, ອີງຕາມປະເພດຂອງພັນທະບັດເຄມີ, ສາມາດມີ 2 ສະຖານະການຜຸພັງທີ່ແຕກຕ່າງກັນ.
ເຈົ້າຕ້ອງການຫຍັງ
- ຕາຕະລາງອົງປະກອບແຕ່ລະໄລຍະ
- ປຶ້ມອ້າງອີງການເຂົ້າເຖິງອິນເຕີເນັດຫຼືເຄມີສາດ
- ເຈ້ຍແຜ່ນ ໜຶ່ງ, ປາກກາຫຼືສໍ
- ເຄື່ອງຄິດເລກ



