ກະວີ:
Virginia Floyd
ວັນທີຂອງການສ້າງ:
6 ສິງຫາ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
ເນື້ອຫາ
- ຂັ້ນຕອນ
- ວິທີການ 1 ຂອງ 3: ພື້ນຖານ
- ວິທີທີ 2 ຂອງ 3: ການກໍານົດປະເພດຂອງພັນທະບັດໂດຍການໃຊ້ electronegativity
- ວິທີທີ 3 ຂອງ 3: ການຄິດໄລ່ Mulliken Electronegativity
- ຄໍາແນະນໍາ
ໃນທາງເຄມີ, electronegativity ແມ່ນຄວາມສາມາດຂອງປະລໍາມະນູເພື່ອດຶງດູດເອເລັກໂຕຣນິກຈາກປະລໍາມະນູອື່ນມາສູ່ພວກມັນ. ປະລໍາມະນູທີ່ມີ electronegativity ສູງດຶງດູດເອເລັກໂຕຣນິກຢ່າງແຂງແຮງ, ແລະປະລໍາມະນູທີ່ມີ electronegativity ຕ່ໍາດຶງດູດເອເລັກໂຕຣນິກໄດ້ຢ່າງອ່ອນແອ. ຄ່າ Electronegativity ຖືກໃຊ້ເພື່ອຄາດການພຶດຕິ ກຳ ຂອງອະຕອມຕ່າງ in ໃນທາດປະສົມເຄມີ.
ຂັ້ນຕອນ
ວິທີການ 1 ຂອງ 3: ພື້ນຖານ
 1 ພັນທະບັດທາງເຄມີ. ພັນທະບັດດັ່ງກ່າວເກີດຂື້ນເມື່ອເອເລັກໂຕຣນິກຢູ່ໃນປະລໍາມະນູພົວພັນກັບກັນແລະກັນ, ນັ້ນແມ່ນສອງເອເລັກໂຕຣນິກ (ອັນດຽວຈາກແຕ່ລະປະລໍາມະນູ) ກາຍເປັນສາມັນ.
1 ພັນທະບັດທາງເຄມີ. ພັນທະບັດດັ່ງກ່າວເກີດຂື້ນເມື່ອເອເລັກໂຕຣນິກຢູ່ໃນປະລໍາມະນູພົວພັນກັບກັນແລະກັນ, ນັ້ນແມ່ນສອງເອເລັກໂຕຣນິກ (ອັນດຽວຈາກແຕ່ລະປະລໍາມະນູ) ກາຍເປັນສາມັນ. - ລາຍລະອຽດຂອງເຫດຜົນສໍາລັບການປະຕິສໍາພັນຂອງເອເລັກໂຕຣນິກຢູ່ໃນປະລໍາມະນູແມ່ນເກີນຂອບເຂດຂອງບົດຄວາມນີ້.ສໍາລັບຂໍ້ມູນເພີ່ມເຕີມກ່ຽວກັບເລື່ອງນີ້, ອ່ານ, ຕົວຢ່າງ, ບົດຄວາມນີ້.
 2 ຜົນກະທົບຂອງການຫຼຸດລົງຂອງໄຟຟ້າ. ເມື່ອສອງປະລໍາມະນູດຶງດູດເອເລັກໂຕຣນິກຂອງກັນແລະກັນ, ແຮງດຶງດູດບໍ່ຄືກັນ. ປະລໍາມະນູທີ່ມີ electronegativity ສູງດຶງດູດສອງເອເລັກໂຕຣນິກຫຼາຍຂຶ້ນ. ປະລໍາມະນູທີ່ມີ electronegativity ສູງຫຼາຍດຶງດູດເອເລັກໂຕຣນິກດ້ວຍກໍາລັງດັ່ງນັ້ນພວກເຮົາບໍ່ໄດ້ເວົ້າກ່ຽວກັບເອເລັກໂຕຣນິກທີ່ໃຊ້ຮ່ວມກັນອີກຕໍ່ໄປ.
2 ຜົນກະທົບຂອງການຫຼຸດລົງຂອງໄຟຟ້າ. ເມື່ອສອງປະລໍາມະນູດຶງດູດເອເລັກໂຕຣນິກຂອງກັນແລະກັນ, ແຮງດຶງດູດບໍ່ຄືກັນ. ປະລໍາມະນູທີ່ມີ electronegativity ສູງດຶງດູດສອງເອເລັກໂຕຣນິກຫຼາຍຂຶ້ນ. ປະລໍາມະນູທີ່ມີ electronegativity ສູງຫຼາຍດຶງດູດເອເລັກໂຕຣນິກດ້ວຍກໍາລັງດັ່ງນັ້ນພວກເຮົາບໍ່ໄດ້ເວົ້າກ່ຽວກັບເອເລັກໂຕຣນິກທີ່ໃຊ້ຮ່ວມກັນອີກຕໍ່ໄປ. - ຕົວຢ່າງ, ໃນໂມເລກຸນ NaCl (sodium chloride, ເກືອທົ່ວໄປ), ປະລໍາມະນູ chlorine ມີ electronegativity ສູງພໍສົມຄວນ, ແລະປະລໍາມະນູ sodium ແມ່ນຕໍ່າຫຼາຍ. ດັ່ງນັ້ນເອເລັກໂຕຣນິກ ຖືກດຶງດູດໃຈກັບປະລໍາມະນູ chlorine ແລະ ຂັບໄລ່ອະຕອມໂຊດຽມ.
 3 ຕາຕະລາງ Electronegativity. ຕາຕະລາງນີ້ປະກອບມີອົງປະກອບທາງເຄມີທີ່ຈັດລຽງໄວ້ໃນລັກສະນະດຽວກັນກັບໃນຕາຕະລາງແຕ່ລະໄລຍະ, ແຕ່ສໍາລັບແຕ່ລະອົງປະກອບຂອງ electronegativity ຂອງປະລໍາມະນູຂອງມັນໄດ້ຖືກມອບໃຫ້. ຕາຕະລາງດັ່ງກ່າວສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມແບບຮຽນວິຊາເຄມີສາດ, ເອກະສານອ້າງອີງ, ແລະໃນເວັບ.
3 ຕາຕະລາງ Electronegativity. ຕາຕະລາງນີ້ປະກອບມີອົງປະກອບທາງເຄມີທີ່ຈັດລຽງໄວ້ໃນລັກສະນະດຽວກັນກັບໃນຕາຕະລາງແຕ່ລະໄລຍະ, ແຕ່ສໍາລັບແຕ່ລະອົງປະກອບຂອງ electronegativity ຂອງປະລໍາມະນູຂອງມັນໄດ້ຖືກມອບໃຫ້. ຕາຕະລາງດັ່ງກ່າວສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມແບບຮຽນວິຊາເຄມີສາດ, ເອກະສານອ້າງອີງ, ແລະໃນເວັບ. - ເຈົ້າຈະພົບເຫັນຕາຕະລາງໄຟຟ້າທີ່ດີເລີດຢູ່ທີ່ນີ້. ຈື່ໄວ້ວ່າມັນໃຊ້ຂະ ໜາດ ການໃຊ້ໄຟຟ້າ Pauling, ເຊິ່ງເປັນອັນທີ່ພົບເຫັນຫຼາຍທີ່ສຸດ. ແນວໃດກໍ່ຕາມ, ຍັງມີວິທີອື່ນໃນການຄິດໄລ່ອັດຕາຄ່າໄຟຟ້າ, ວິທີ ໜຶ່ງ ທີ່ຈະໄດ້ເວົ້າເຖິງລຸ່ມນີ້.
 4 ແນວໂນ້ມຂອງ Electronegativity. ຖ້າເຈົ້າບໍ່ມີຕາຕະລາງ electronegativity ຢູ່ໃນມື, ເຈົ້າສາມາດຄາດຄະເນອັດຕາການໄຟຟ້າຂອງອະຕອມໂດຍທີ່ຕັ້ງຂອງອົງປະກອບຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ.
4 ແນວໂນ້ມຂອງ Electronegativity. ຖ້າເຈົ້າບໍ່ມີຕາຕະລາງ electronegativity ຢູ່ໃນມື, ເຈົ້າສາມາດຄາດຄະເນອັດຕາການໄຟຟ້າຂອງອະຕອມໂດຍທີ່ຕັ້ງຂອງອົງປະກອບຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ. - ແນວໃດ ໄປທາງຂວາ ອົງປະກອບແມ່ນຕັ້ງຢູ່, ໄດ້ ເພີ່ມເຕີມ electronegativity ຂອງອະຕອມຂອງມັນ.
- ແນວໃດ ສູງກວ່າ ອົງປະກອບແມ່ນຕັ້ງຢູ່, ໄດ້ ເພີ່ມເຕີມ electronegativity ຂອງອະຕອມຂອງມັນ.
- ດັ່ງນັ້ນ, ປະລໍາມະນູຂອງອົງປະກອບທີ່ຕັ້ງຢູ່ໃນມຸມຂວາເທິງຂອງຕາຕະລາງແຕ່ລະໄລຍະມີການສະສົມໄຟຟ້າສູງສຸດ, ແລະປະລໍາມະນູຂອງອົງປະກອບທີ່ຕັ້ງຢູ່ໃນມຸມຊ້າຍລຸ່ມມີຕ່ ຳ ສຸດ.
- ໃນຕົວຢ່າງ NaCl ຂອງພວກເຮົາ, ພວກເຮົາສາມາດເວົ້າໄດ້ວ່າ chlorine ມີ electronegativity ສູງກ່ວາ sodium, ເພາະວ່າ chlorine ຕັ້ງຢູ່ທາງດ້ານຂວາຂອງ sodium.
ວິທີທີ 2 ຂອງ 3: ການກໍານົດປະເພດຂອງພັນທະບັດໂດຍການໃຊ້ electronegativity
 1 ຄິດໄລ່ຄວາມແຕກຕ່າງລະຫວ່າງການສະສົມໄຟຟ້າຂອງສອງປະລໍາມະນູເພື່ອເຂົ້າໃຈລັກສະນະຂອງພັນທະບັດລະຫວ່າງພວກມັນ. ເພື່ອເຮັດສິ່ງນີ້, ຈົ່ງຫັກລົບຄວາມແຮງໄຟຟ້າທີ່ນ້ອຍກວ່າອອກຈາກອັນທີ່ໃຫຍ່ກວ່າ.
1 ຄິດໄລ່ຄວາມແຕກຕ່າງລະຫວ່າງການສະສົມໄຟຟ້າຂອງສອງປະລໍາມະນູເພື່ອເຂົ້າໃຈລັກສະນະຂອງພັນທະບັດລະຫວ່າງພວກມັນ. ເພື່ອເຮັດສິ່ງນີ້, ຈົ່ງຫັກລົບຄວາມແຮງໄຟຟ້າທີ່ນ້ອຍກວ່າອອກຈາກອັນທີ່ໃຫຍ່ກວ່າ. - ຕົວຢ່າງ, ພິຈາລະນາໂມເລກຸນ HF. ຫັກລົບ electronegativity ຂອງ hydrogen (2.1) ຈາກ electronegativity ຂອງ fluorine (4.0): 4.0 - 2.1 = 1,9.
 2 ຖ້າຄວາມແຕກຕ່າງ ໜ້ອຍ ກວ່າ 0.5, ຈາກນັ້ນພັນທະບັດແມ່ນ covalent ບໍ່ມີຂົ້ວໂລກ, ເຊິ່ງເອເລັກໂຕຣນິກຖືກດຶງດູດດ້ວຍຄວາມແຮງເກືອບເທົ່າກັນ. ພັນທະບັດດັ່ງກ່າວຖືກສ້າງຂຶ້ນລະຫວ່າງສອງປະລໍາມະນູທີ່ຄືກັນ. ການເຊື່ອມຕໍ່ທີ່ບໍ່ແມ່ນຂົ້ວໂດຍທົ່ວໄປແມ່ນຍາກຫຼາຍທີ່ຈະ ທຳ ລາຍ. ນີ້ແມ່ນຍ້ອນວ່າປະລໍາມະນູແບ່ງປັນເອເລັກໂຕຣນິກ, ເຊິ່ງເຮັດໃຫ້ພັນທະບັດຂອງພວກມັນ.ັ້ນຄົງ. ມັນຕ້ອງໃຊ້ພະລັງງານຫຼາຍເພື່ອທໍາລາຍມັນ.
2 ຖ້າຄວາມແຕກຕ່າງ ໜ້ອຍ ກວ່າ 0.5, ຈາກນັ້ນພັນທະບັດແມ່ນ covalent ບໍ່ມີຂົ້ວໂລກ, ເຊິ່ງເອເລັກໂຕຣນິກຖືກດຶງດູດດ້ວຍຄວາມແຮງເກືອບເທົ່າກັນ. ພັນທະບັດດັ່ງກ່າວຖືກສ້າງຂຶ້ນລະຫວ່າງສອງປະລໍາມະນູທີ່ຄືກັນ. ການເຊື່ອມຕໍ່ທີ່ບໍ່ແມ່ນຂົ້ວໂດຍທົ່ວໄປແມ່ນຍາກຫຼາຍທີ່ຈະ ທຳ ລາຍ. ນີ້ແມ່ນຍ້ອນວ່າປະລໍາມະນູແບ່ງປັນເອເລັກໂຕຣນິກ, ເຊິ່ງເຮັດໃຫ້ພັນທະບັດຂອງພວກມັນ.ັ້ນຄົງ. ມັນຕ້ອງໃຊ້ພະລັງງານຫຼາຍເພື່ອທໍາລາຍມັນ. - ຕົວຢ່າງ, ໂມເລກຸນ O2 ມີການເຊື່ອມຕໍ່ປະເພດນີ້. ເນື່ອງຈາກປະລໍາມະນູອົກຊີແຊນສອງໂຕມີການສະສົມໄຟຟ້າຄືກັນ, ຄວາມແຕກຕ່າງລະຫວ່າງພວກມັນແມ່ນ 0.
 3 ຖ້າຄວາມແຕກຕ່າງຢູ່ໃນລະຫວ່າງ 0.5 - 1.6, ຈາກນັ້ນພັນທະບັດແມ່ນຂົ້ວໂລກ covalent. ໃນກໍລະນີນີ້, ໜຶ່ງ ໃນສອງປະລໍາມະນູດຶງດູດເອເລັກໂຕຣນິກໄດ້ຫຼາຍຂຶ້ນແລະດັ່ງນັ້ນຈິ່ງໄດ້ຮັບຜິດຊອບດ້ານລົບເປັນບາງສ່ວນ, ແລະອີກອັນ ໜຶ່ງ ເປັນການຮັບຜິດຊອບເປັນບວກບາງສ່ວນ. ຄວາມບໍ່ສົມດຸນຂອງຄ່າໃຊ້ຈ່າຍນີ້ອະນຸຍາດໃຫ້ໂມເລກຸນເຂົ້າຮ່ວມໃນປະຕິກິລິຍາບາງຢ່າງ.
3 ຖ້າຄວາມແຕກຕ່າງຢູ່ໃນລະຫວ່າງ 0.5 - 1.6, ຈາກນັ້ນພັນທະບັດແມ່ນຂົ້ວໂລກ covalent. ໃນກໍລະນີນີ້, ໜຶ່ງ ໃນສອງປະລໍາມະນູດຶງດູດເອເລັກໂຕຣນິກໄດ້ຫຼາຍຂຶ້ນແລະດັ່ງນັ້ນຈິ່ງໄດ້ຮັບຜິດຊອບດ້ານລົບເປັນບາງສ່ວນ, ແລະອີກອັນ ໜຶ່ງ ເປັນການຮັບຜິດຊອບເປັນບວກບາງສ່ວນ. ຄວາມບໍ່ສົມດຸນຂອງຄ່າໃຊ້ຈ່າຍນີ້ອະນຸຍາດໃຫ້ໂມເລກຸນເຂົ້າຮ່ວມໃນປະຕິກິລິຍາບາງຢ່າງ. - ຕົວຢ່າງ, ໂມເລກຸນ H2O (ນ້ ຳ) ມີພັນທະປະເພດນີ້. ປະລໍາມະນູ O ແມ່ນມີເອເລັກໂຕຣນິກຫຼາຍກ່ວາສອງປະລໍາມະນູ H, ສະນັ້ນອົກຊີເຈນດຶງດູດເອເລັກໂຕຣນິກໄດ້ຫຼາຍຂຶ້ນແລະຮັບເອົາຄ່າປະຕິເສດບາງສ່ວນ, ແລະໄຮໂດຣເຈນ - ມີຄ່າເປັນບວກບາງສ່ວນ.
 4 ຖ້າຄວາມແຕກຕ່າງຫຼາຍກວ່າ 2.0, ສະນັ້ນພັນທະບັດແມ່ນເປັນທາດ ionic. ນີ້ແມ່ນພັນທະບັດທີ່ຄູ່ເອເລັກໂຕຣນິກທົ່ວໄປສ່ວນໃຫຍ່ຜ່ານໄປສູ່ປະລໍາມະນູທີ່ມີ electronegativity ສູງກວ່າ, ເຊິ່ງໄດ້ຮັບຄ່າລົບ, ແລະປະລໍາມະນູທີ່ມີ electronegativity ຕ່ ຳ ຈະໄດ້ຮັບການຄິດຄ່າບວກ. ໂມເລກຸນທີ່ມີພັນທະດັ່ງກ່າວມີປະຕິກິລິຍາໄດ້ດີກັບອະຕອມອື່ນ and ແລະແມ້ແຕ່ສາມາດຖືກ ທຳ ລາຍດ້ວຍອະຕອມຂົ້ວໂລກ.
4 ຖ້າຄວາມແຕກຕ່າງຫຼາຍກວ່າ 2.0, ສະນັ້ນພັນທະບັດແມ່ນເປັນທາດ ionic. ນີ້ແມ່ນພັນທະບັດທີ່ຄູ່ເອເລັກໂຕຣນິກທົ່ວໄປສ່ວນໃຫຍ່ຜ່ານໄປສູ່ປະລໍາມະນູທີ່ມີ electronegativity ສູງກວ່າ, ເຊິ່ງໄດ້ຮັບຄ່າລົບ, ແລະປະລໍາມະນູທີ່ມີ electronegativity ຕ່ ຳ ຈະໄດ້ຮັບການຄິດຄ່າບວກ. ໂມເລກຸນທີ່ມີພັນທະດັ່ງກ່າວມີປະຕິກິລິຍາໄດ້ດີກັບອະຕອມອື່ນ and ແລະແມ້ແຕ່ສາມາດຖືກ ທຳ ລາຍດ້ວຍອະຕອມຂົ້ວໂລກ. - ຕົວຢ່າງ, ໂມເລກຸນ NaCl (sodium chloride) ມີພັນທະປະເພດນີ້.ປະລໍາມະນູ chlorine ແມ່ນເປັນເອເລັກໂຕຣນິກທີ່ມັນດຶງດູດທັງສອງເອເລັກໂຕຣນິກເຂົ້າໄປໃນຕົວຂອງມັນເອງແລະໄດ້ຮັບການຮັບຜິດຊອບທາງລົບ, ແລະປະລໍາມະນູ sodium ໄດ້ຮັບເປັນປະຈຸບວກ.
- NaCl ສາມາດຖືກ ທຳ ລາຍໂດຍໂມເລກຸນຂົ້ວໂລກເຊັ່ນ: H2O (ນ້ ຳ). ຢູ່ໃນໂມເລກຸນນ້ ຳ, ດ້ານໄຮໂດຣເຈນຂອງໂມເລກຸນແມ່ນເປັນບວກແລະດ້ານອົກຊີເຈນແມ່ນເປັນລົບ. ຖ້າເຈົ້າປະສົມເກືອກັບນໍ້າ, ໂມເລກຸນນໍ້າທໍາລາຍໂມເລກຸນເກືອ, ເຮັດໃຫ້ມັນລະລາຍ.
 5 ຖ້າຄວາມແຕກຕ່າງລະຫວ່າງ 1.6 ຫາ 2.0, ກວດເບິ່ງໂລຫະ. ຖ້າປະລໍາມະນູໂລຫະມີຢູ່ໃນໂມເລກຸນ, ຈາກນັ້ນພັນທະບັດແມ່ນທາດ ionic. ຖ້າບໍ່ມີອະຕອມໂລຫະຢູ່ໃນໂມເລກຸນ, ຈາກນັ້ນພັນທະບັດແມ່ນໂຄວາເລັນຂົ້ວໂລກ.
5 ຖ້າຄວາມແຕກຕ່າງລະຫວ່າງ 1.6 ຫາ 2.0, ກວດເບິ່ງໂລຫະ. ຖ້າປະລໍາມະນູໂລຫະມີຢູ່ໃນໂມເລກຸນ, ຈາກນັ້ນພັນທະບັດແມ່ນທາດ ionic. ຖ້າບໍ່ມີອະຕອມໂລຫະຢູ່ໃນໂມເລກຸນ, ຈາກນັ້ນພັນທະບັດແມ່ນໂຄວາເລັນຂົ້ວໂລກ. - ໂລຫະຕັ້ງຢູ່ທາງຊ້າຍແລະໃຈກາງຂອງຕາຕະລາງແຕ່ລະໄລຍະ. ໃນຕາຕະລາງນີ້, ໂລຫະຖືກເນັ້ນໃຫ້ເຫັນ.
- ໃນຕົວຢ່າງ HF ຂອງພວກເຮົາ, ຄວາມແຕກຕ່າງລະຫວ່າງການສະສົມໄຟຟ້າຕົກຢູ່ໃນຂອບເຂດນີ້. ເນື່ອງຈາກ H ແລະ F ບໍ່ແມ່ນໂລຫະ, ພັນທະບັດ covalent ຂົ້ວໂລກ.
ວິທີທີ 3 ຂອງ 3: ການຄິດໄລ່ Mulliken Electronegativity
 1 ຊອກຫາພະລັງງານ ionization ທໍາອິດຂອງອະຕອມ. ຂະ ໜາດ ໄຟຟ້າ Mulliken ແມ່ນແຕກຕ່າງເລັກນ້ອຍຈາກຂະ ໜາດ Pauling ທີ່ໄດ້ກ່າວມາຂ້າງເທິງ. ພະລັງງານ ionization ທໍາອິດແມ່ນຈໍາເປັນເພື່ອເອົາຫນຶ່ງປະລໍາມະນູອອກຈາກເອເລັກໂຕຣນິກ.
1 ຊອກຫາພະລັງງານ ionization ທໍາອິດຂອງອະຕອມ. ຂະ ໜາດ ໄຟຟ້າ Mulliken ແມ່ນແຕກຕ່າງເລັກນ້ອຍຈາກຂະ ໜາດ Pauling ທີ່ໄດ້ກ່າວມາຂ້າງເທິງ. ພະລັງງານ ionization ທໍາອິດແມ່ນຈໍາເປັນເພື່ອເອົາຫນຶ່ງປະລໍາມະນູອອກຈາກເອເລັກໂຕຣນິກ. - ຄວາມofາຍຂອງພະລັງງານດັ່ງກ່າວສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມກະສານອ້າງອີງທາງເຄມີຫຼືຢູ່ໃນເນັດ, ຕົວຢ່າງ, ຢູ່ທີ່ນີ້.
- ເປັນຕົວຢ່າງ, ໃຫ້ພວກເຮົາຊອກຫາຄ່າໄຟຟ້າຂອງ lithium (Li). ພະລັງງານ ionization ທໍາອິດຂອງມັນແມ່ນ 520 kJ / mol.
 2 ຊອກຫາພະລັງງານຂອງຄວາມສໍາພັນກັບເອເລັກໂຕຣນິກ. ນີ້ແມ່ນພະລັງງານທີ່ປ່ອຍອອກມາໃນຂະບວນການຕິດເອເລັກໂຕຣນິກເຂົ້າກັບອາຕອມ. ຄວາມofາຍຂອງພະລັງງານດັ່ງກ່າວສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມກະສານອ້າງອີງທາງເຄມີຫຼືຢູ່ໃນເນັດ, ຕົວຢ່າງ, ຢູ່ທີ່ນີ້.
2 ຊອກຫາພະລັງງານຂອງຄວາມສໍາພັນກັບເອເລັກໂຕຣນິກ. ນີ້ແມ່ນພະລັງງານທີ່ປ່ອຍອອກມາໃນຂະບວນການຕິດເອເລັກໂຕຣນິກເຂົ້າກັບອາຕອມ. ຄວາມofາຍຂອງພະລັງງານດັ່ງກ່າວສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມກະສານອ້າງອີງທາງເຄມີຫຼືຢູ່ໃນເນັດ, ຕົວຢ່າງ, ຢູ່ທີ່ນີ້. - ພະລັງງານຄວາມ ສຳ ພັນເອເລັກໂຕຣນິກຂອງລິທຽມແມ່ນ 60 kJ / mol.
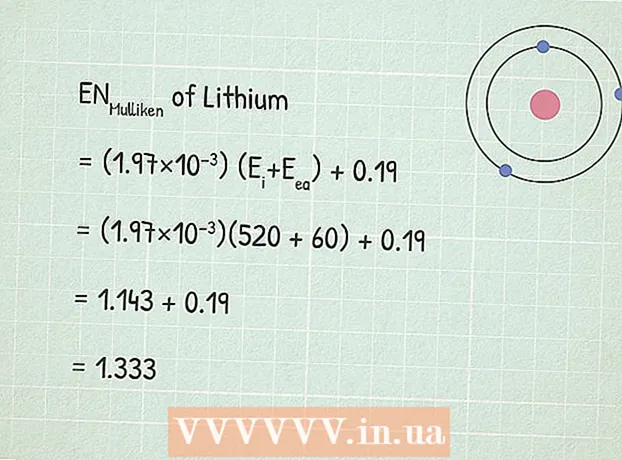
 3 ໃຊ້ສົມຜົນການໄຟຟ້າຂອງ Mulliken:ຣູມູລຽນເຄນ = (1.97 × 10) (ຈຂ້າພະເຈົ້າ+ ອີea) + 0,19.
3 ໃຊ້ສົມຜົນການໄຟຟ້າຂອງ Mulliken:ຣູມູລຽນເຄນ = (1.97 × 10) (ຈຂ້າພະເຈົ້າ+ ອີea) + 0,19. - ໃນຕົວຢ່າງຂອງພວກເຮົາ:
- ຣູມູລຽນເຄນ = (1.97 × 10) (ຈຂ້າພະເຈົ້າ+ ອີea) + 0,19
- ຣູມູລຽນເຄນ = (1,97×10)(520 + 60) + 0,19
- ຣູມູລຽນເຄນ = 1,143 + 0,19 = 1,333
- ໃນຕົວຢ່າງຂອງພວກເຮົາ:
ຄໍາແນະນໍາ
- ນອກ ເໜືອ ໄປຈາກເກັດ Pauling ແລະ Mulliken, ຍັງມີເກັດໄຟຟ້າສະຖິດຢູ່ຕາມ Allred-Rochow, Sanderson, Allen. ເຂົາເຈົ້າທັງhaveົດມີສູດຄິດໄລ່ຂອງເຂົາເຈົ້າເອງໃນການຄິດໄລ່ electronegativity (ບາງອັນແມ່ນຂ້ອນຂ້າງສັບສົນ).
- Electronegativity ບໍ່ມີ ໜ່ວຍ ວັດແທກ.



