ກະວີ:
Janice Evans
ວັນທີຂອງການສ້າງ:
25 ເດືອນກໍລະກົດ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
ເນື້ອຫາ
ສົມຜົນ Ionic ແມ່ນສ່ວນ ໜຶ່ງ ຂອງເຄມີສາດ. ພວກມັນມີພຽງແຕ່ສ່ວນປະກອບເຫຼົ່ານັ້ນທີ່ປ່ຽນແປງໃນລະຫວ່າງການປະຕິກິລິຍາທາງເຄມີ. ສ່ວນຫຼາຍແລ້ວ, ສົມຜົນ ionic ຖືກໃຊ້ເພື່ອພັນລະນາປະຕິກິລິຍາ redox, ການແລກປ່ຽນແລະປະຕິກິລິຍາເປັນກາງ.ການຂຽນສົມຜົນ ionic ຕ້ອງການສາມຂັ້ນຕອນຂັ້ນພື້ນຖານ: ການດຸ່ນດ່ຽງສົມຜົນໂມເລກຸນຂອງປະຕິກິລິຍາທາງເຄມີ, ແປມັນໃຫ້ເປັນສົມຜົນ ionic ສົມບູນ (ນັ້ນຄືການຂຽນສ່ວນປະກອບຕາມທີ່ມີຢູ່ໃນການແກ້ໄຂ), ແລະສຸດທ້າຍຂຽນສົມຜົນ ionic ສັ້ນ.
ຂັ້ນຕອນ
ສ່ວນທີ 1 ຂອງ 2: ອົງປະກອບຂອງສົມຜົນ Ionic
 1 ເຂົ້າໃຈຄວາມແຕກຕ່າງລະຫວ່າງໂມເລກຸນແລະ ທາດປະສົມທາດ ionic. ເພື່ອຂຽນສົມຜົນ ionic, ຂັ້ນຕອນທໍາອິດແມ່ນເພື່ອກໍານົດທາດປະສົມ ionic ທີ່ກ່ຽວຂ້ອງກັບປະຕິກິລິຍາ. ສານ Ionic ແມ່ນສານທີ່ແຍກຕົວ (ຍ່ອຍສະຫຼາຍ) ອອກເປັນໄອອອນທີ່ມີການຄິດໄລ່ໃນການແກ້ໄຂບັນຫານໍ້າ. ທາດປະສົມໂມເລກຸນບໍ່ແຕກແຍກເປັນໄອອອນ. ພວກມັນປະກອບດ້ວຍສອງອົງປະກອບທີ່ບໍ່ແມ່ນໂລຫະແລະບາງຄັ້ງກໍ່ຖືກເອີ້ນວ່າທາດປະສົມ covalent.
1 ເຂົ້າໃຈຄວາມແຕກຕ່າງລະຫວ່າງໂມເລກຸນແລະ ທາດປະສົມທາດ ionic. ເພື່ອຂຽນສົມຜົນ ionic, ຂັ້ນຕອນທໍາອິດແມ່ນເພື່ອກໍານົດທາດປະສົມ ionic ທີ່ກ່ຽວຂ້ອງກັບປະຕິກິລິຍາ. ສານ Ionic ແມ່ນສານທີ່ແຍກຕົວ (ຍ່ອຍສະຫຼາຍ) ອອກເປັນໄອອອນທີ່ມີການຄິດໄລ່ໃນການແກ້ໄຂບັນຫານໍ້າ. ທາດປະສົມໂມເລກຸນບໍ່ແຕກແຍກເປັນໄອອອນ. ພວກມັນປະກອບດ້ວຍສອງອົງປະກອບທີ່ບໍ່ແມ່ນໂລຫະແລະບາງຄັ້ງກໍ່ຖືກເອີ້ນວ່າທາດປະສົມ covalent. - ທາດປະສົມໄອອອນສາມາດເກີດຂຶ້ນໄດ້ລະຫວ່າງໂລຫະແລະໂລຫະທີ່ບໍ່ແມ່ນໂລຫະ, ໂລຫະແລະໄອອອນ polyatomic, ຫຼືລະຫວ່າງ ions polyatomic ຫຼາຍອັນ.
- ຖ້າເຈົ້າມີຄວາມສົງໃສວ່າກຸ່ມໃດເປັນສານປະກອບສະເພາະຂອງກຸ່ມນັ້ນ, ເບິ່ງທີ່ຄຸນສົມບັດຂອງອົງປະກອບຂອງມັນຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ.
 2 ກໍານົດການລະລາຍຂອງທາດປະສົມ. ບໍ່ແມ່ນທາດປະສົມທາດ ionic ທັງdissolveົດລະລາຍໃນການແກ້ໄຂບັນຫານໍ້າ, ນັ້ນແມ່ນ, ບໍ່ແມ່ນພວກມັນທັງdissົດແຍກອອກເປັນໄອອອນແຍກຕ່າງຫາກ. ກ່ອນທີ່ເຈົ້າຈະເລີ່ມຂຽນສົມຜົນ, ເຈົ້າຄວນຊອກຫາຄວາມລະລາຍຂອງແຕ່ລະທາດປະສົມ. ຂ້າງລຸ່ມນີ້ແມ່ນກົດລະບຽບສັ້ນ brief ສໍາລັບການລະລາຍ. ລາຍລະອຽດເພີ່ມເຕີມແລະຂໍ້ຍົກເວັ້ນຕໍ່ກັບກົດລະບຽບສາມາດພົບໄດ້ຢູ່ໃນຕາຕະລາງການລະລາຍ.
2 ກໍານົດການລະລາຍຂອງທາດປະສົມ. ບໍ່ແມ່ນທາດປະສົມທາດ ionic ທັງdissolveົດລະລາຍໃນການແກ້ໄຂບັນຫານໍ້າ, ນັ້ນແມ່ນ, ບໍ່ແມ່ນພວກມັນທັງdissົດແຍກອອກເປັນໄອອອນແຍກຕ່າງຫາກ. ກ່ອນທີ່ເຈົ້າຈະເລີ່ມຂຽນສົມຜົນ, ເຈົ້າຄວນຊອກຫາຄວາມລະລາຍຂອງແຕ່ລະທາດປະສົມ. ຂ້າງລຸ່ມນີ້ແມ່ນກົດລະບຽບສັ້ນ brief ສໍາລັບການລະລາຍ. ລາຍລະອຽດເພີ່ມເຕີມແລະຂໍ້ຍົກເວັ້ນຕໍ່ກັບກົດລະບຽບສາມາດພົບໄດ້ຢູ່ໃນຕາຕະລາງການລະລາຍ. - ປະຕິບັດຕາມກົດລະບຽບຕາມ ລຳ ດັບທີ່ພວກມັນໄດ້ໃຫ້ຢູ່ລຸ່ມນີ້:
- ເກືອທັງNaົດ Na, K ແລະ NH4 ລະລາຍ;
- ເກືອທັງNOົດ NO3, ຄ2ຮ3ໂອ2, ClO3 ແລະ ClO4 ລະລາຍ;
- ເກືອທັງAgົດ Ag, Pb ແລະ Hg2 ລະລາຍ;
- ເກືອທັງClົດ Cl, Br ແລະ I ລະລາຍ;
- ເກືອ CO3, O, S, OH, PO4, CrO4, Cr2ໂອ7 ແລະ SO3 ບໍ່ສາມາດລະລາຍໄດ້ (ມີຂໍ້ຍົກເວັ້ນບາງອັນ);
- ເກືອ SO4 ລະລາຍໄດ້ (ມີຂໍ້ຍົກເວັ້ນບາງອັນ).
 3 ກໍານົດທາດປະສົມແລະທາດປະສົມຂອງທາດປະສົມ. ໄອອອນທີ່ມີການຄິດຄ່າໃນທາງບວກ (ປົກກະຕິແລ້ວແມ່ນໂລຫະ) ຖືກເອີ້ນວ່າ cation. ທາດ anions ມີການຄິດຄ່າລົບ, ໂດຍປົກກະຕິແລ້ວແມ່ນທາດເຫຼັກທີ່ບໍ່ແມ່ນໂລຫະ. ໂລຫະທີ່ບໍ່ແມ່ນໂລຫະບາງຊະນິດສາມາດປະກອບເປັນບໍ່ພຽງແຕ່ anions, ແຕ່ຍັງເປັນ cation, ໃນຂະນະທີ່ປະລໍາມະນູໂລຫະປະຕິບັດເປັນ cation ຢູ່ສະເີ.
3 ກໍານົດທາດປະສົມແລະທາດປະສົມຂອງທາດປະສົມ. ໄອອອນທີ່ມີການຄິດຄ່າໃນທາງບວກ (ປົກກະຕິແລ້ວແມ່ນໂລຫະ) ຖືກເອີ້ນວ່າ cation. ທາດ anions ມີການຄິດຄ່າລົບ, ໂດຍປົກກະຕິແລ້ວແມ່ນທາດເຫຼັກທີ່ບໍ່ແມ່ນໂລຫະ. ໂລຫະທີ່ບໍ່ແມ່ນໂລຫະບາງຊະນິດສາມາດປະກອບເປັນບໍ່ພຽງແຕ່ anions, ແຕ່ຍັງເປັນ cation, ໃນຂະນະທີ່ປະລໍາມະນູໂລຫະປະຕິບັດເປັນ cation ຢູ່ສະເີ. - ຕົວຢ່າງ, ໃນທາດປະສົມ NaCl (ເກືອໃນຕາຕະລາງ), Na ເປັນທາດຊີມັງທີ່ມີການຄິດຄ່າໃນທາງບວກເນື່ອງຈາກວ່າມັນເປັນໂລຫະແລະ Cl ເປັນ anion ທີ່ມີການຄິດຄ່າລົບເນື່ອງຈາກມັນເປັນໂລຫະທີ່ບໍ່ແມ່ນໂລຫະ.
 4 ກໍານົດໄອອອນ polyatomic (ສະລັບສັບຊ້ອນ) ທີ່ກ່ຽວຂ້ອງກັບປະຕິກິລິຍາ. ໄອອອນດັ່ງກ່າວແມ່ນເປັນໂມເລກຸນທີ່ມີຄ່າ, ລະຫວ່າງປະລໍາມະນູຂອງມັນມີຄວາມຜູກພັນທີ່ ແໜ້ນ ໜາ ທີ່ພວກມັນບໍ່ແຕກແຍກກັນໃນປະຕິກິລິຍາທາງເຄມີ. ມັນເປັນສິ່ງຈໍາເປັນເພື່ອກໍານົດ ions polyatomic, ເນື່ອງຈາກວ່າພວກມັນມີຄວາມຮັບຜິດຊອບຂອງມັນເອງແລະບໍ່ສະຫລາຍຕົວເຂົ້າໄປໃນປະລໍາມະນູຂອງແຕ່ລະຄົນ. ໄອອອນ Polyatomic ສາມາດມີໄດ້ທັງທາງບວກແລະທາງລົບ.
4 ກໍານົດໄອອອນ polyatomic (ສະລັບສັບຊ້ອນ) ທີ່ກ່ຽວຂ້ອງກັບປະຕິກິລິຍາ. ໄອອອນດັ່ງກ່າວແມ່ນເປັນໂມເລກຸນທີ່ມີຄ່າ, ລະຫວ່າງປະລໍາມະນູຂອງມັນມີຄວາມຜູກພັນທີ່ ແໜ້ນ ໜາ ທີ່ພວກມັນບໍ່ແຕກແຍກກັນໃນປະຕິກິລິຍາທາງເຄມີ. ມັນເປັນສິ່ງຈໍາເປັນເພື່ອກໍານົດ ions polyatomic, ເນື່ອງຈາກວ່າພວກມັນມີຄວາມຮັບຜິດຊອບຂອງມັນເອງແລະບໍ່ສະຫລາຍຕົວເຂົ້າໄປໃນປະລໍາມະນູຂອງແຕ່ລະຄົນ. ໄອອອນ Polyatomic ສາມາດມີໄດ້ທັງທາງບວກແລະທາງລົບ. - ໃນຫຼັກສູດເຄມີທົ່ວໄປຂອງເຈົ້າ, ເຈົ້າອາດຈະຈໍາເປັນຕ້ອງໄດ້ຈົດຈໍາບາງສ່ວນຂອງໄອອອນ polyatomic ທົ່ວໄປທີ່ສຸດ.
- ທາດ ion polyatomic ທົ່ວໄປທີ່ສຸດແມ່ນ CO3, ບໍ່3, ບໍ່2, ສ4, ສ3, ClO4 ແລະ ClO3.
- ມີທາດ ion polyatomic ອື່ນ many ອີກຫຼາຍຢ່າງທີ່ສາມາດພົບໄດ້ຢູ່ໃນປຶ້ມແບບຮຽນກ່ຽວກັບເຄມີສາດຫຼືໃນອິນເຕີເນັດ.
ສ່ວນທີ 2 ຂອງ 2: ການຂຽນສົມຜົນ Ionic
 1 ດຸ່ນດ່ຽງສົມຜົນໂມເລກຸນສົມບູນ. ກ່ອນທີ່ເຈົ້າຈະເລີ່ມຂຽນສົມຜົນ ionic, ເຈົ້າຕ້ອງດຸ່ນດ່ຽງສົມຜົນໂມເລກຸນເດີມ. ເພື່ອເຮັດສິ່ງນີ້, ມັນຈໍາເປັນຕ້ອງວາງຕົວຄູນທີ່ສອດຄ້ອງກັນຢູ່ທາງ ໜ້າ ຂອງທາດປະສົມ, ເພື່ອໃຫ້ຈໍານວນອະຕອມຂອງແຕ່ລະອົງປະກອບຢູ່ເບື້ອງຊ້າຍເທົ່າກັບຕົວເລກຂອງມັນຢູ່ເບື້ອງຂວາຂອງສົມຜົນ.
1 ດຸ່ນດ່ຽງສົມຜົນໂມເລກຸນສົມບູນ. ກ່ອນທີ່ເຈົ້າຈະເລີ່ມຂຽນສົມຜົນ ionic, ເຈົ້າຕ້ອງດຸ່ນດ່ຽງສົມຜົນໂມເລກຸນເດີມ. ເພື່ອເຮັດສິ່ງນີ້, ມັນຈໍາເປັນຕ້ອງວາງຕົວຄູນທີ່ສອດຄ້ອງກັນຢູ່ທາງ ໜ້າ ຂອງທາດປະສົມ, ເພື່ອໃຫ້ຈໍານວນອະຕອມຂອງແຕ່ລະອົງປະກອບຢູ່ເບື້ອງຊ້າຍເທົ່າກັບຕົວເລກຂອງມັນຢູ່ເບື້ອງຂວາຂອງສົມຜົນ. - ຂຽນຈໍານວນຂອງປະລໍາມະນູສໍາລັບແຕ່ລະອົງປະກອບຢູ່ຂ້າງຂອງສົມຜົນທັງສອງຂ້າງ.
- ເພີ່ມຄ່າ ສຳ ປະສິດກ່ອນອົງປະກອບຕ່າງ except (ຍົກເວັ້ນອົກຊີແລະໄຮໂດເຈນ) ເພື່ອໃຫ້ ຈຳ ນວນອະຕອມຂອງແຕ່ລະອົງປະກອບຢູ່ເບື້ອງຊ້າຍແລະຂວາຂອງສົມຜົນຄືກັນ.
- ດຸ່ນດ່ຽງປະລໍາມະນູ hydrogen.
- ດຸ່ນດ່ຽງປະລໍາມະນູອົກຊີເຈນ.
- ນັບ ຈຳ ນວນອະຕອມ ສຳ ລັບແຕ່ລະອົງປະກອບຢູ່ຂ້າງໃດ ໜຶ່ງ ຂອງສົມຜົນແລະໃຫ້ແນ່ໃຈວ່າມັນຄືກັນ.
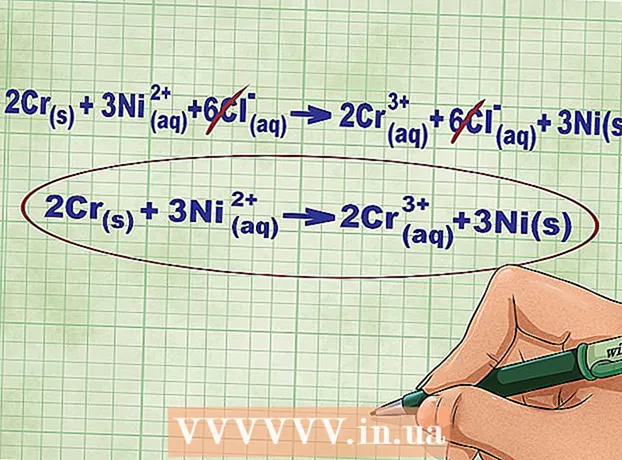
- ຕົວຢ່າງ, ຫຼັງຈາກການດຸ່ນດ່ຽງສົມຜົນ Cr + NiCl2 -> CrCl3 + Ni ພວກເຮົາໄດ້ຮັບ 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni
 2 ກໍານົດສະພາບຂອງແຕ່ລະສານທີ່ເຂົ້າຮ່ວມໃນປະຕິກິລິຍາ. ອັນນີ້ສາມາດຖືກຕັດສິນໂດຍສະພາບຂອງບັນຫາ. ມີກົດລະບຽບສະເພາະທີ່ຊ່ວຍກໍານົດວ່າອົງປະກອບຫຼືການເຊື່ອມຕໍ່ຢູ່ໃນສະຖານະໃດ.
2 ກໍານົດສະພາບຂອງແຕ່ລະສານທີ່ເຂົ້າຮ່ວມໃນປະຕິກິລິຍາ. ອັນນີ້ສາມາດຖືກຕັດສິນໂດຍສະພາບຂອງບັນຫາ. ມີກົດລະບຽບສະເພາະທີ່ຊ່ວຍກໍານົດວ່າອົງປະກອບຫຼືການເຊື່ອມຕໍ່ຢູ່ໃນສະຖານະໃດ. - ຖ້າສະຖານະຂອງອົງປະກອບສະເພາະໃດ ໜຶ່ງ ບໍ່ໄດ້ຊີ້ບອກຢູ່ໃນສະພາບຂອງບັນຫາ, ໃຫ້ໃຊ້ຕາຕະລາງແຕ່ລະໄລຍະເພື່ອກໍານົດມັນ.
- ຖ້າສະພາບການເວົ້າວ່າສານປະສົມຢູ່ໃນການແກ້ໄຂ, ໃຫ້markາຍມັນໄວ້ (rr).
- ຖ້ານໍ້າລວມຢູ່ໃນສົມຜົນ, ໃຊ້ຕາຕະລາງການລະລາຍເພື່ອກໍານົດວ່າທາດປະສົມທາດ ionic ຈະແຍກອອກຈາກກັນຫຼືບໍ່. ໃນກໍລະນີທີ່ມີການລະລາຍສູງ, ທາດປະສົມຈະແຍກຕົວຢູ່ໃນນໍ້າ (rr). ຖ້າທາດປະສົມມີການລະລາຍຕໍ່າ, ມັນຈະຍັງຄົງແຂງຢູ່ (ໂທລະທັດ).
- ຖ້ານໍ້າບໍ່ເຂົ້າຮ່ວມໃນປະຕິກິລິຍາ, ທາດປະສົມທາດ ionic ຈະຍັງຄົງຢູ່ໃນຮູບແບບແຂງ (ໂທລະທັດ).
- ຖ້າມີກົດຫຼືຖານປະກົດຢູ່ໃນບັນຫາ, ພວກມັນຈະຖືກລະລາຍລົງໃນນໍ້າ (rr).
- ເປັນຕົວຢ່າງ, ພິຈາລະນາປະຕິກິລິຍາ 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni ໃນຮູບແບບບໍລິສຸດ, ອົງປະກອບ Cr ແລະ Ni ຢູ່ໃນໄລຍະແຂງ. NiCl2 ແລະ CrCl3 ແມ່ນທາດປະສົມທາດ ionic ທີ່ລະລາຍໄດ້, ນັ້ນແມ່ນ, ພວກມັນຢູ່ໃນການແກ້ໄຂ. ດັ່ງນັ້ນ, ສົມຜົນນີ້ສາມາດຖືກຂຽນຄືນໃ່ໄດ້ດັ່ງນີ້: 2Cr(ໂທລະທັດ) + 3NiCl2(rr) -> 2CrCl3(rr) + 3Ni(ໂທລະທັດ).
 3 ກຳ ນົດວ່າທາດປະສົມໃດທີ່ແຍກອອກຈາກກັນ (ແຍກອອກເປັນ cation ແລະ anions) ໃນການແກ້ໄຂ. ພາຍຫຼັງການແຍກຕົວອອກ, ທາດປະສົມຈະເນົ່າເປື່ອຍກາຍເປັນສ່ວນປະກອບໃນທາງບວກ (cation) ແລະດ້ານລົບ (anion). ຈາກນັ້ນອົງປະກອບເຫຼົ່ານີ້ຈະເຂົ້າໄປໃນສົມຜົນ ionic ຂອງປະຕິກິລິຍາທາງເຄມີ.
3 ກຳ ນົດວ່າທາດປະສົມໃດທີ່ແຍກອອກຈາກກັນ (ແຍກອອກເປັນ cation ແລະ anions) ໃນການແກ້ໄຂ. ພາຍຫຼັງການແຍກຕົວອອກ, ທາດປະສົມຈະເນົ່າເປື່ອຍກາຍເປັນສ່ວນປະກອບໃນທາງບວກ (cation) ແລະດ້ານລົບ (anion). ຈາກນັ້ນອົງປະກອບເຫຼົ່ານີ້ຈະເຂົ້າໄປໃນສົມຜົນ ionic ຂອງປະຕິກິລິຍາທາງເຄມີ. - ທາດແຫຼວ, ທາດແຫຼວ, ທາດອາຍ, ທາດປະສົມໂມເລກຸນ, ທາດປະສົມທາດ ionic ທີ່ມີຄວາມລະລາຍໄດ້ຕໍ່າ, ທາດໄອອອນໂພລີຕຼອມແລະອາຊິດທີ່ອ່ອນແອບໍ່ແຕກແຍກ.
- ແຍກທາດປະສົມທາດ ionic ທີ່ລະລາຍສູງໄດ້ຢ່າງເຕັມສ່ວນ (ໃຊ້ຕາຕະລາງການລະລາຍ) ແລະອາຊິດທີ່ເຂັ້ມແຂງ (HCl(rr), HBr(rr), ຮສ(rr), ຮ2ດັ່ງນັ້ນ4(rr), HClO4(rr) ແລະ HNO3(rr)).
- ໃຫ້ສັງເກດວ່າເຖິງແມ່ນວ່າໄອອອນ polyatomic ບໍ່ແຍກກັນ, ພວກມັນສາມາດຖືກລວມເຂົ້າກັບທາດປະສົມທາດ ionic ແລະແຍກອອກຈາກມັນໄດ້ໃນການແກ້ໄຂ.
 4 ຄິດໄລ່ການຄິດໄລ່ຂອງແຕ່ລະ ion ແຍກຕ່າງຫາກ. ໃນການເຮັດເຊັ່ນນັ້ນ, ຈື່ໄວ້ວ່າໂລຫະປະກອບເປັນ cations ທີ່ມີການຄິດຄ່າໃນທາງບວກ, ແລະປະລໍາມະນູທີ່ບໍ່ແມ່ນໂລຫະປ່ຽນເປັນ anions ລົບ. ກຳ ນົດຄ່າຂອງອົງປະກອບຕາມຕາຕະລາງແຕ່ລະໄລຍະ. ມັນຍັງມີຄວາມຈໍາເປັນເພື່ອດຸ່ນດ່ຽງການຄິດຄ່າທັງinົດຢູ່ໃນທາດປະສົມທີ່ເປັນກາງ.
4 ຄິດໄລ່ການຄິດໄລ່ຂອງແຕ່ລະ ion ແຍກຕ່າງຫາກ. ໃນການເຮັດເຊັ່ນນັ້ນ, ຈື່ໄວ້ວ່າໂລຫະປະກອບເປັນ cations ທີ່ມີການຄິດຄ່າໃນທາງບວກ, ແລະປະລໍາມະນູທີ່ບໍ່ແມ່ນໂລຫະປ່ຽນເປັນ anions ລົບ. ກຳ ນົດຄ່າຂອງອົງປະກອບຕາມຕາຕະລາງແຕ່ລະໄລຍະ. ມັນຍັງມີຄວາມຈໍາເປັນເພື່ອດຸ່ນດ່ຽງການຄິດຄ່າທັງinົດຢູ່ໃນທາດປະສົມທີ່ເປັນກາງ. - ໃນຕົວຢ່າງຂ້າງເທິງ, NiCl2 ແຍກອອກເປັນ Ni ແລະ Cl, ແລະ CrCl3 decomposes ເຂົ້າໄປໃນ Cr ແລະ Cl.
- ນີອອນນິກເກີມີການສາກ 2+ ເພາະວ່າມັນມີຄວາມຜູກພັນກັບໄອອອນ chlorine ສອງອັນ, ແຕ່ລະອັນມີການສາກໄຟລົບພຽງອັນດຽວ. ໃນກໍລະນີນີ້, Ni ion ໜຶ່ງ ໜ່ວຍ ຕ້ອງດຸ່ນດ່ຽງສອງ Cl ions ທີ່ຄິດຄ່າລົບ. Cr ion ມີການສາກໄຟ 3+, ເພາະວ່າມັນຈະຕ້ອງທໍາລາຍທາດ Cl ions ທີ່ມີການຄິດຄ່າລົບສາມຢ່າງ.
- ຈື່ໄວ້ວ່າໄອອອນ polyatomic ມີຄ່າຂອງມັນເອງ.
 5 ຂຽນສົມຜົນຄືນໃso່ເພື່ອໃຫ້ທາດປະສົມທີ່ລະລາຍທັງareົດຖືກແຍກອອກເປັນໄອອອນແຕ່ລະອັນ. ອັນໃດກໍ່ຕາມທີ່ແຍກອອກຈາກກັນຫຼື ionizes (ຄືກັບອາຊິດທີ່ເຂັ້ມແຂງ) ແບ່ງອອກເປັນສອງ ions ແຍກຕ່າງຫາກ. ໃນກໍລະນີນີ້, ສານຈະຍັງຄົງຢູ່ໃນສະພາບລະລາຍ (rr). ກວດເບິ່ງວ່າສົມຜົນສົມດຸນ.
5 ຂຽນສົມຜົນຄືນໃso່ເພື່ອໃຫ້ທາດປະສົມທີ່ລະລາຍທັງareົດຖືກແຍກອອກເປັນໄອອອນແຕ່ລະອັນ. ອັນໃດກໍ່ຕາມທີ່ແຍກອອກຈາກກັນຫຼື ionizes (ຄືກັບອາຊິດທີ່ເຂັ້ມແຂງ) ແບ່ງອອກເປັນສອງ ions ແຍກຕ່າງຫາກ. ໃນກໍລະນີນີ້, ສານຈະຍັງຄົງຢູ່ໃນສະພາບລະລາຍ (rr). ກວດເບິ່ງວ່າສົມຜົນສົມດຸນ. - ທາດແຂງ, ທາດແຫຼວ, ທາດອາຍ, ອາຊິດອ່ອນແລະທາດປະສົມທາດ ionic ທີ່ມີຄວາມລະລາຍຕໍ່າຈະບໍ່ປ່ຽນສະຖານະຂອງມັນແລະຈະບໍ່ແຍກອອກເປັນໄອອອນ. ປ່ອຍໃຫ້ພວກເຂົາເປັນຄືເກົ່າ.
- ທາດປະສົມໂມເລກຸນຈະກະແຈກກະຈາຍຢູ່ໃນການແກ້ໄຂ, ແລະສະພາບຂອງມັນຈະປ່ຽນໄປເປັນການລະລາຍ (rr). ມີສາມທາດປະກອບໂມເລກຸນທີ່ ບໍ່ ຈະໄປຫາລັດ (rr), ນີ້ແມ່ນ CH4(ຈ), ຄ3ຮ8(ຈ) ແລະ C8ຮ18(ສ).
- ສໍາລັບປະຕິກິລິຍາທີ່ກໍາລັງພິຈາລະນາ, ສົມຜົນ ionic ສົມບູນສາມາດຂຽນໄດ້ໃນຮູບແບບຕໍ່ໄປນີ້: 2Cr(ໂທລະທັດ) + 3Ni(rr) + 6Cl(rr) -> 2Cr(rr) + 6Cl(rr) + 3Ni(ໂທລະທັດ)... ຖ້າ chlorine ບໍ່ແມ່ນສ່ວນ ໜຶ່ງ ຂອງທາດປະສົມ, ມັນຈະແຕກເປັນອາຕອມແຕ່ລະຕົວ, ສະນັ້ນພວກເຮົາຄູນ ຈຳ ນວນ Cl ions ດ້ວຍ 6 ທັງສອງດ້ານຂອງສົມຜົນ.
 6 ຍົກເລີກ ions ທີ່ເທົ່າທຽມກັນຢູ່ດ້ານຊ້າຍແລະຂວາຂອງສົມຜົນ. ເຈົ້າພຽງແຕ່ສາມາດຂ້າມ ions ເຫຼົ່ານັ້ນທີ່ມີລັກສະນະຄ້າຍຄືກັນທັງສອງດ້ານຂອງສົມຜົນ (ມີຄ່າບໍລິການດຽວກັນ, ຕົວຫຍໍ້, ແລະອື່ນ on). ຂຽນສົມຜົນຄືນໃwithout່ໂດຍບໍ່ມີໄອອອນເຫຼົ່ານີ້.
6 ຍົກເລີກ ions ທີ່ເທົ່າທຽມກັນຢູ່ດ້ານຊ້າຍແລະຂວາຂອງສົມຜົນ. ເຈົ້າພຽງແຕ່ສາມາດຂ້າມ ions ເຫຼົ່ານັ້ນທີ່ມີລັກສະນະຄ້າຍຄືກັນທັງສອງດ້ານຂອງສົມຜົນ (ມີຄ່າບໍລິການດຽວກັນ, ຕົວຫຍໍ້, ແລະອື່ນ on). ຂຽນສົມຜົນຄືນໃwithout່ໂດຍບໍ່ມີໄອອອນເຫຼົ່ານີ້. - ໃນຕົວຢ່າງຂອງພວກເຮົາ, ທັງສອງດ້ານຂອງສົມຜົນປະກອບດ້ວຍ 6 Cl ions ທີ່ສາມາດຂ້າມອອກໄປໄດ້. ດັ່ງນັ້ນ, ພວກເຮົາໄດ້ຮັບສົມຜົນ ionic ສັ້ນ: 2Cr(ໂທລະທັດ) + 3Ni(rr) -> 2Cr(rr) + 3Ni(ໂທລະທັດ).
- ກວດເບິ່ງຜົນໄດ້ຮັບ. ການຄິດຄ່າທັງofົດຂອງຂ້າງຊ້າຍແລະຂວາຂອງສົມຜົນ ionic ຕ້ອງເທົ່າກັນ.
ຄໍາແນະນໍາ
- Trainຶກອົບຮົມຕົວທ່ານເອງ ສະເີ ຂຽນສະຖານະການລວມຂອງສ່ວນປະກອບທັງinົດໄວ້ໃນສົມຜົນທັງofົດຂອງປະຕິກິລິຍາທາງເຄມີ.