ກະວີ:
Monica Porter
ວັນທີຂອງການສ້າງ:
22 ດົນໆ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
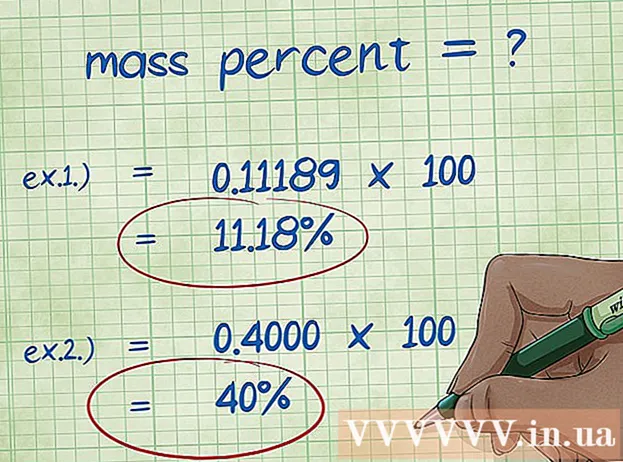
ເນື້ອຫາ
ເປີເຊັນມະຫາຊົນສະແດງເຖິງເປີເຊັນຂອງແຕ່ລະທາດໃນທາດປະສົມສານເຄມີ. ເພື່ອຊອກຫາອັດຕາສ່ວນມະຫາຊົນ, ໜຶ່ງ ທ່ານຕ້ອງຮູ້ຈັກມະຫາຊົນໂມເລກຸນຂອງທາດຕ່າງໆທີ່ຢູ່ໃນສານປະສົມໃນປະລິມານກຼາມ / ມມຫຼື ຈຳ ນວນຂອງກຼາມຂອງສານທີ່ປະກອບເຂົ້າໃນການແກ້ໄຂ. ອັດຕາສ່ວນມວນແມ່ນຖືກຄິດໄລ່ໂດຍໃຊ້ສູດງ່າຍໆທີ່ຈະແບ່ງສ່ວນຂອງທາດ (ຫຼືລະລາຍ) ໂດຍມະຫາສານຂອງສານປະສົມ (ຫຼືວິທີແກ້ໄຂ).
ຂັ້ນຕອນ
ວິທີທີ່ 1 ຂອງ 2: ຄິດໄລ່ອັດຕາສ່ວນມວນສານເມື່ອຮູ້ຈັກມະຫາຊົນ
ກຳ ນົດສົມຜົນ ສຳ ລັບເປີເຊັນຂອງມວນໃນປະສົມ. ສູດພື້ນຖານ ສຳ ລັບການຄິດໄລ່ອັດຕາສ່ວນຮ້ອຍໃນການປະສົມແມ່ນ: ອັດຕາສ່ວນຮ້ອຍ = (ມວນສານທີ່ມີຄຸນນະພາບ / ມວນສານປະສົມ) x 100. ສຸດທ້າຍທ່ານຕ້ອງຄູນດ້ວຍ 100 ເພື່ອສະແດງມູນຄ່າເປີເຊັນ.
- ຂຽນສົມຜົນເມື່ອທ່ານເລີ່ມຕົ້ນແກ້ໄຂບັນຫາ: ເປີເຊັນມະຫາຊົນ = (ສານມະຫາຊົນ / ມວນສານປະສົມ) x 100.
- ປະລິມານຂອງຄຸນນະພາບຈະຖືກມອບໃຫ້ໃນບັນຫາ. ຖ້າຫົວຂໍ້ບໍ່ໄດ້ໃຫ້, ກະລຸນາເບິ່ງໃນພາກຕໍ່ໄປນີ້ກ່ຽວກັບວິທີການຊອກຫາອັດຕາສ່ວນມະຫາຊົນໂດຍບໍ່ຮູ້ວ່າມີນໍ້າ ໜັກ.
- ມວນສານປະສົມເທົ່າກັບມວນສານທັງ ໝົດ ຂອງສານທີ່ປະກອບເປັນສ່ວນປະສົມຫຼືວິທີແກ້ໄຂ.

ຄິດໄລ່ມວນສານປະສົມ. ເມື່ອທ່ານຮູ້ ຈຳ ນວນມະຫາສານຂອງອົງປະກອບຫລືທາດປະສົມ, ສິ່ງທີ່ທ່ານຕ້ອງເຮັດກໍ່ຄືເພີ່ມພວກມັນເພື່ອໃຫ້ມວນສານຂອງສ່ວນປະສົມຫລືວິທີແກ້ໄຂສຸດທ້າຍ. ນີ້ແມ່ນຕົວຫານໃນສູດ ສຳ ລັບມະຫາຊົນເປີເຊັນ.- ຕົວຢ່າງ 1: ອັດຕາສ່ວນມວນຂອງ 5 g ຂອງ sodium hydroxide ເມື່ອລະລາຍໃນນ້ ຳ 100g ແມ່ນຫຍັງ?
- ມະຫາຊົນຂອງການປະສົມແມ່ນ ຈຳ ນວນທັງ ໝົດ ຂອງ sodium hydroxide ແລະນ້ ຳ: 100g + 5g. ດັ່ງນັ້ນນ້ ຳ ໜັກ ປະສົມແມ່ນ 105g.
- ຕົວຢ່າງ 2: ປະລິມານໃດແດ່ຂອງ sodium chloride ແລະນ້ ຳ ທີ່ຕ້ອງການເພື່ອປະກອບເປັນ 175g ໃນການແກ້ໄຂ 15%?
- ໃນຕົວຢ່າງນີ້, ບ່ອນທີ່ທ່ານຮູ້ຈັກມວນສານປະສົມແລະອັດຕາສ່ວນມະຫາຊົນ, ໜ້າ ວຽກຮຽກຮ້ອງໃຫ້ຊອກຫາປະລິມານຂອງການລະລາຍເພີ່ມ. ມະຫາຊົນຂອງການປະສົມແມ່ນ 175 g.
- ຕົວຢ່າງ 1: ອັດຕາສ່ວນມວນຂອງ 5 g ຂອງ sodium hydroxide ເມື່ອລະລາຍໃນນ້ ຳ 100g ແມ່ນຫຍັງ?

ກຳ ນົດ ຈຳ ນວນມະຫາສານຂອງສານເພື່ອຫາ ຈຳ ນວນສ່ວນຮ້ອຍ. ເມື່ອການສອບຖາມຂໍໃຫ້ຊອກຫາ "ເປີເຊັນຂອງມວນສານ" ຂອງສານ, ທ່ານຕ້ອງຊອກຫາທາດມະຫາສານເປັນສ່ວນຮ້ອຍຂອງມວນທັງ ໝົດ ຂອງສ່ວນປະກອບທັງ ໝົດ. ຂຽນ ຈຳ ນວນຂອງສານເພື່ອຊອກຫາ ຈຳ ນວນສ່ວນຮ້ອຍ. ນີ້ແມ່ນຕົວເລກໃນສູດ ສຳ ລັບມວນສານເປີເຊັນ.- ຕົວຢ່າງທີ 1: ມະຫາຊົນຂອງ sodium hydroxide (ສານທີ່ຈະພົບເຫັນດ້ວຍສ່ວນປະກອບມະຫາຊົນ) ແມ່ນ 5g.
- ຕົວຢ່າງທີ 2: ໃນຕົວຢ່າງນີ້, ປະລິມານຂອງສານ ກຳ ລັງຊອກຫາເປີເຊັນຂອງມວນທີ່ບໍ່ຮູ້ຈັກ, ແລະທ່ານ ກຳ ລັງຊອກຫາມັນຢູ່.

ປ່ຽນຕົວແປກັບສົມຜົນເປີເຊັນມະຫາສານ. ເມື່ອທ່ານໄດ້ ກຳ ນົດຄ່າຂອງແຕ່ລະຕົວແປ, ພຽງແຕ່ສຽບໃສ່ສົມຜົນ.- ຕົວຢ່າງ 1: ອັດຕາສ່ວນຮ້ອຍ = (ສານສ່ວນປະສົມຂອງສານ / ມະຫາຊົນປະສົມ) x 100 = (5 g / 105 g) x 100.
- ຕົວຢ່າງທີ 2: ພວກເຮົາ ຈຳ ເປັນຕ້ອງປ່ຽນສົມຜົນສ່ວນຮ້ອຍຂອງມວນເພື່ອ ຄຳ ນວນປະລິມານຂອງຄຸນນະພາບທີ່ບໍ່ຮູ້ຈັກ: ມະຫາຊົນທີ່ມີຄຸນນະພາບ = (ຈຳ ນວນມະຫາຊົນຮ້ອຍສ່ວນຮ້ອຍ * ມະຫາຊົນປະສົມ) / 100 = (15 * 175) / 100 .
ຄິດໄລ່ເປີເຊັນປະລິມານ. ໃນປັດຈຸບັນທີ່ສົມຜົນໄດ້ຖືກເຕີມ, ທ່ານພຽງແຕ່ຕ້ອງການຄິດໄລ່ອັດຕາສ່ວນມະຫາຊົນ. ແບ່ງສ່ວນປະກອບຂອງສານໂດຍ ຈຳ ນວນມະຫາສານຂອງສ່ວນປະສົມ, ຈາກນັ້ນກໍ່ຄູນມັນລົງ 100. ນີ້ແມ່ນອັດຕາສ່ວນມະຫາສານຂອງສານໃນສ່ວນປະສົມ.
- ຕົວຢ່າງທີ 1: (5/105) x 100 = 0.04761 x 100 = 4,761%. ສະນັ້ນອັດຕາສ່ວນມວນຂອງ 5 g ຂອງ sodium hydroxide ລະລາຍໃນນ້ ຳ 100g ແມ່ນ 4,761%.
- ຕົວຢ່າງທີ 2: ສົມຜົນຫລັງຈາກປ່ຽນມາຄິດໄລ່ປະລິມານຄຸນນະພາບແມ່ນ (ຈຳ ນວນມະຫາຊົນຮ້ອຍສ່ວນຮ້ອຍ * ນ້ ຳ ໜັກ ປະສົມ) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 ກຣາມ chloride sodium.
- ນ້ ຳ ໜັກ ຂອງນ້ ຳ ເພີ່ມແມ່ນ ຈຳ ນວນມະຫາສານຂອງສ່ວນປະສົມລົບລົບນ້ ຳ ໜັກ ຂອງສານ: 175 - 26,25 = 148,75 ກຼາມຂອງນ້ ຳ.
ວິທີທີ່ 2 ຂອງ 2: ຄິດໄລ່ອັດຕາສ່ວນມວນສານໃນເວລາທີ່ບໍ່ຮູ້ຈັກມວນສານ
ກຳ ນົດສົມຜົນ ສຳ ລັບເປີເຊັນຂອງມວນໃນສານປະສົມ. ສູດພື້ນຖານ ສຳ ລັບການຄິດໄລ່ອັດຕາສ່ວນມວນໃນທາດປະສົມແມ່ນ: ອັດຕາສ່ວນຮ້ອຍ = (ໂມເລກຸນຂອງທາດ / ມະຫາຊົນຊັ້ນໂມ້ທາດປະສົມ) x 100. ໃນຂະນະທີ່ມະຫາຊົນໂມເລກຸນແມ່ນມະຫາຊົນຂອງໂມເລກຸນປະສົມ ໜຶ່ງ ໜ່ວຍ. ສຸດທ້າຍ, ທ່ານຕ້ອງໄດ້ຄູນດ້ວຍ 100 ເພື່ອໃຫ້ໄດ້ມູນຄ່າເປີເຊັນ.
- ຂຽນສົມຜົນເມື່ອທ່ານເລີ່ມຕົ້ນແກ້ໄຂບັນຫາ: ເປີເຊັນມະຫາຊົນ = (ມະຫາຊົນ molar ອົງປະກອບ / ມະຫາຊົນ molar ຂອງທາດປະສົມ) x 100.
- ຫົວ ໜ່ວຍ ຂອງມູນຄ່າທັງສອງຂ້າງເທິງແມ່ນກຼາມຕໍ່ກິໂລກຼາມຕໍ່ກິໂລ (g / mol).
- ໃນເວລາທີ່ບັນຫາບໍ່ໃຫ້ມວນສານ, ທ່ານສາມາດໃຊ້ໂມໂມເມກເພື່ອຄິດໄລ່ອັດຕາສ່ວນຂອງອົງປະກອບ.
- ຕົວຢ່າງ 1: ຄິດໄລ່ອັດຕາສ່ວນມວນຂອງ hydrogen ໃນໂມເລກຸນນ້ ຳ.
- ຕົວຢ່າງ 2: ຄິດໄລ່ອັດຕາສ່ວນມວນສານຂອງຄາບອນໃນໂມເລກຸນທາດນ້ ຳ ຕານ.
ຂຽນ ສູດເຄມີ. ຖ້າບັນຫາດັ່ງກ່າວບໍ່ໄດ້ກວມເອົາສູດທາດເຄມີ ສຳ ລັບແຕ່ລະສານປະສົມ, ທ່ານ ຈຳ ເປັນຕ້ອງຂຽນມັນລົງ. ຖ້າປັນຫາ ສຳ ລັບສູດເຄມີ, ໃຫ້ຂ້າມຂັ້ນຕອນນີ້ແລະໄປທີ່ "ຊອກຫາມວນສານຂອງແຕ່ລະອົງປະກອບ".
- ຕົວຢ່າງ 1: ຂຽນສູດສານເຄມີ ສຳ ລັບນ້ ຳ, H2ອ.
- ຕົວຢ່າງທີ 2: ຂຽນສູດສານເຄມີ ສຳ ລັບນ້ ຳ ຕານ, C6ຮ12ອ6.
ຊອກຫາມະຫາຊົນຂອງແຕ່ລະອົງປະກອບໃນສານປະສົມ. ຊອກຫານໍ້າ ໜັກ ໂມເລກຸນຂອງແຕ່ລະອົງປະກອບໃນສູດເຄມີໃນຕາຕະລາງແຕ່ລະໄລຍະ. ມວນສານສ່ວນປະກອບແມ່ນຂຽນຕາມສັນຍາລັກທາງເຄມີ. ຂຽນ ຈຳ ນວນມະຫາສານຂອງແຕ່ລະອົງປະກອບໃນສານປະສົມ.
- ຕົວຢ່າງ 1: ພວກເຮົາສາມາດຄົ້ນພົບວ່າອະຕອມຂອງອົກຊີເຈນແມ່ນ 15,9994; ແລະອະຕອມຂອງ hydrogen ແມ່ນ 1,0079.
- ຕົວຢ່າງທີ 2: ພວກເຮົາພົບວ່າປະລໍາມະນູຂອງກາກບອນແມ່ນ 12,0107; ອົກຊີເຈນແມ່ນ 15,9994; ແລະ hydrogen ແມ່ນ 1.0079.
ຄູນປະລໍາມະນູກ້ອນໂດຍອັດຕາສ່ວນໂມ້. ກໍານົດຈໍານວນຂອງ moles (ອັດຕາສ່ວນ molar) ຂອງແຕ່ລະອົງປະກອບໃນສານປະສົມສານເຄມີ. ອັດຕາສ່ວນໂມ້ໄດ້ຖືກຄິດໄລ່ໂດຍ ຈຳ ນວນນ້ອຍຂ້າງລຸ່ມນີ້ໃນສູດປະສົມສານເຄມີ. ຄູນປະລໍາມະນູກ້ອນຂອງແຕ່ລະອົງປະກອບໂດຍອັດຕາສ່ວນຂອງໂມ.
- ຕົວຢ່າງ 1: ໄຮໂດເຈນມີຕົວຫຍໍ້ຂອງສອງໃນຂະນະທີ່ອົກຊີເຈນມີຕົວຫຍໍ້ຂອງ 1. ດັ່ງນັ້ນຄູນນ້ ຳ ໜັກ ໂມເລກຸນຂອງ hydrogen ໂດຍ 2, 1,00794 X 2 = 2.01588; ແລະໂມເລກຸນໂມເລກຸນແມ່ນ 15,9994 (ຄູນ ໜຶ່ງ).
- ຕົວຢ່າງ 2: ກາກບອນມີຕົວຫຍໍ້ຂອງ 6, hydrogen ແມ່ນ 12, ແລະອົກຊີເຈນແມ່ນ 6. ຄູນອະຕອມຂອງແຕ່ລະອົງປະກອບຕາມດັດຊະນີຂ້າງລຸ່ມ.
- ກາກບອນ (12,0107 * 6) = 72,0642
- ໄຮໂດເຈນ (1,00794 * 12) = 12.09528
- ອົກຊີເຈນ (15,9994 * 6) = 95,9964
ຄິດໄລ່ມວນສານທັງ ໝົດ ຂອງສານປະສົມ. ເພີ່ມມວນສານຂອງທຸກໆອົງປະກອບໃນສານປະສົມ. ທ່ານສາມາດຄິດໄລ່ປະລິມານສານປະສົມທັງ ໝົດ ໂດຍໃຊ້ມວນສານທີ່ສະແດງອອກໃນອັດຕາສ່ວນໂມ້. ຕົວເລກນີ້ຈະເປັນຕົວຫານໃນສົມຜົນມະຫາຊົນສ່ວນຮ້ອຍ.
- ຕົວຢ່າງ 1: ເພີ່ມ 2,01588 g / mol (ມວນຂອງສອງໂມເລກຸນຂອງປະລໍາມະນູ hydrogen) ເປັນ 15,9994 g / mol (ມວນຂອງໂມເລກຸນ ໜຶ່ງ ໂມເລກຸນ) ໃຫ້ 18.01528 g / mol.
- ຕົວຢ່າງທີ 2: ຕື່ມນ້ ຳ ໜັກ ທັງ ໝົດ ພ້ອມກັນ: ຄາບອນ + hydrogen + oxygen = 72,0642 + 12,09528 + 95,9964 = 180,156 g / mol.
ກຳ ນົດ ຈຳ ນວນຂອງສ່ວນປະກອບທີ່ຈະຖືກຄິດໄລ່. ເມື່ອບັນຫາຮຽກຮ້ອງ "ເປີເຊັນມະຫາຊົນ", ມັນ ໝາຍ ຄວາມວ່າທ່ານຕ້ອງໄດ້ຊອກຫາມວນສານຂອງສ່ວນປະກອບໃດ ໜຶ່ງ ໃນທາດປະສົມເປັນເປີເຊັນຂອງມວນສານທັງ ໝົດ ຂອງອົງປະກອບທັງ ໝົດ. ກຳ ນົດແລະຂຽນມະຫາສານຂອງອົງປະກອບ. ມະຫາຊົນນີ້ແມ່ນມວນທີ່ສະແດງອອກໃນອັດຕາສ່ວນຂອງໂມ້. ຕົວເລກນີ້ແມ່ນຕົວເລກຂອງສົມຜົນມະຫາສານຮ້ອຍເປີເຊັນ.
- ຕົວຢ່າງທີ 1: ມະຫາຊົນຂອງທາດໄຮໂດເຈນໃນທາດປະສົມແມ່ນ 2,01588 g / mol (ມະຫາຊົນຂອງສອງອະຕອມຂອງປະລໍາມະນູ hydrogen).
- ຕົວຢ່າງທີ 2: ມວນສານກາກບອນໃນທາດປະສົມແມ່ນ 72,0642 g / mol (ມະຫາຊົນຂອງອະຕອມຂອງກາກບອນຫົກໄມ).
ປ່ຽນຕົວແປກັບສົມຜົນເປີເຊັນມະຫາສານ. ຫຼັງຈາກການ ກຳ ນົດຄຸນຄ່າຂອງແຕ່ລະຕົວປ່ຽນ, ພຽງແຕ່ທົດແທນພວກມັນໂດຍສົມຜົນທີ່ໄດ້ລະບຸໃນຂັ້ນຕອນ ທຳ ອິດ: ອັດຕາສ່ວນຮ້ອຍ = (ໂມເລກຸນຂອງມະຫາຊົນ / ທາດໂມກຂອງທາດປະສົມ) x 100 .
- ຕົວຢ່າງ 1: ອັດຕາສ່ວນມະຫາຊົນ = (ມະຫາຊົນໂມເລກຸນ / ມະຫາຊົນຊັ້ນໂມ້ປະສົມ) x 100 = (2,1588 / 18,1528) x 100.
- ຕົວຢ່າງທີ 2: ອັດຕາສ່ວນມວນ = = (ມະຫາສານໂມເລກຸນ / ທາດໂມ້ຂອງທາດປະສົມ) x 100 = (72,0642 / 180,156) x 100.
ຄິດໄລ່ເປີເຊັນປະລິມານ. ໃນປັດຈຸບັນທີ່ສົມຜົນໄດ້ຖືກເຕີມ, ທ່ານພຽງແຕ່ຕ້ອງການຄິດໄລ່ອັດຕາສ່ວນມະຫາຊົນ. ແບ່ງ ຈຳ ນວນຂອງອົງປະກອບໂດຍ ຈຳ ນວນມວນທັງ ໝົດ ຂອງທາດປະສົມ, ຫຼັງຈາກນັ້ນຄູນມັນລົງ 100. ນີ້ແມ່ນເປີເຊັນຂອງມວນຂອງທາດໃນທາດປະສົມ.
- ຕົວຢ່າງ 1: ຈຳ ນວນມະຫາຊົນ = (2,01588 / 18,01528) x 100 = 0.111189 x 100 = 11.18%. ດັ່ງນັ້ນ, ອັດຕາສ່ວນມະຫາຊົນຂອງອະຕອມຂອງໄຮໂດເຈນໃນໂມເລກຸນນ້ ຳ ແມ່ນ 11,18%.
- ຕົວຢ່າງທີ 2: ອັດຕາສ່ວນມວນ = = (ໂມເລກຸນທາດປະສົມ / ມວນສານໂມ້ທາດປະສົມ) x 100 = (72,0642 / 180,156) x 100 = 0.4000 x 100 = 40.00%. ສະນັ້ນອັດຕາສ່ວນມະຫາຊົນຂອງອະຕອມຄາບອນໃນທາດໂມເລກຸນແມ່ນ 40,00%.