ກະວີ:
Randy Alexander
ວັນທີຂອງການສ້າງ:
25 ເດືອນເມສາ 2021
ວັນທີປັບປຸງ:
26 ມິຖຸນາ 2024
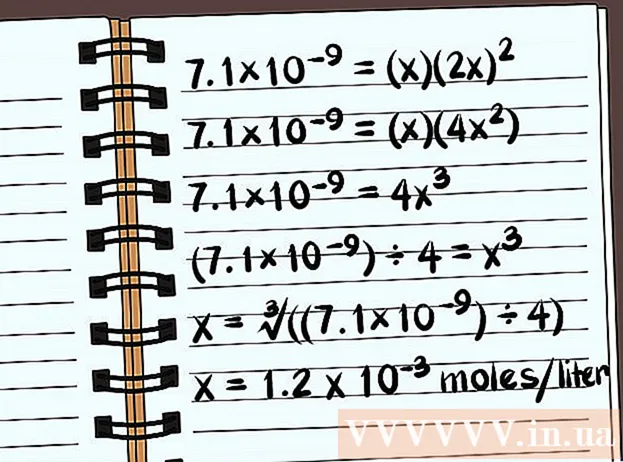
ເນື້ອຫາ
ໃນເຄມີສາດ, ການລະລາຍແມ່ນໃຊ້ເພື່ອອະທິບາຍເຖິງຄຸນສົມບັດຂອງທາດປະສົມໃນເວລາທີ່ມັນຖືກລະລາຍໃນທາດແຫຼວຢ່າງສົມບູນໂດຍບໍ່ຕ້ອງປ່ອຍສານຕົກຄ້າງທີ່ລະລາຍອອກມາ. ມີພຽງແຕ່ທາດປະສົມ ionic (ຄິດຄ່າ ທຳ ນຽມ) ເທົ່ານັ້ນ. ໃນຄວາມເປັນຈິງ, ທ່ານພຽງແຕ່ຕ້ອງການຈື່ ຈຳ ກົດລະບຽບບໍ່ຫຼາຍປານໃດຫຼືຄົ້ນຫາວັນນະຄະດີເພື່ອຈະຮູ້ວ່າສານປະສົມທາດໄຊງ່ອນຈະຍັງຄົງແຂງຢູ່ບໍເມື່ອເພີ່ມເຂົ້າໃນນ້ ຳ ຫຼືຖ້າປະລິມານຫຼາຍກໍ່ຈະລະລາຍ. ໃນຄວາມເປັນຈິງ, ຈຳ ນວນໂມເລກຸນ ຈຳ ນວນ ໜຶ່ງ ຈະລະລາຍເຖິງແມ່ນວ່າທ່ານບໍ່ເຫັນການປ່ຽນແປງໃດໆ, ສະນັ້ນ ສຳ ລັບການທົດລອງໃຫ້ຖືກຕ້ອງທ່ານຕ້ອງຮູ້ວິທີທີ່ຈະຄິດໄລ່ປະລິມານໂມເລກຸນນີ້.
ຂັ້ນຕອນ
ວິທີທີ່ 1 ຂອງ 2: ໃຊ້ກົດລະບຽບດ່ວນ
ຮຽນຮູ້ກ່ຽວກັບທາດປະສົມທາດ ionic. ແຕ່ລະປະລໍາມະນູມັກຈະມີ ຈຳ ນວນເອເລັກໂຕຣນິກທີ່ແນ່ນອນ, ແຕ່ບາງຄັ້ງມັນຈະເອົາຫລືປ່ອຍເອເລັກໂທຣນິກໄປ. ຂະບວນການນີ້ເຮັດໃຫ້ມັນເປັນອັນ ໜຶ່ງ ions ຄິດຄ່າ ທຳ ນຽມ. ເມື່ອໄອອອນທີ່ມີຄ່າໄຟຟ້າລົບ (ເກີນ ໜຶ່ງ ຂອງເອເລັກໂທຣນິກ) ພົບກັບໄອອອນທີ່ມີຄ່າໄຟຟ້າບວກ (ຂາດໄຟຟ້າ), ພວກມັນຈະຜູກພັນກັນເຊັ່ນ cathode ແລະ anode ຂອງສອງແມ່ເຫຼັກ. ຜົນໄດ້ຮັບປະກອບເປັນສານປະສົມ ionic.
- Ions ມີຄ່າໃຊ້ຈ່າຍໃນທາງລົບທີ່ເອີ້ນວ່າ anions, ແລະ ions ມີຄ່າໃຊ້ຈ່າຍໃນທາງບວກທີ່ເອີ້ນວ່າ cation.
- ປົກກະຕິແລ້ວ ຈຳ ນວນເອເລັກໂຕຣນິກໃນອະຕອມແມ່ນເທົ່າກັບ ຈຳ ນວນໂປໂຕຄອນ, ສະນັ້ນມັນບໍ່ມີຄ່າໃຊ້ຈ່າຍໃດໆ.

ເຂົ້າໃຈເຖິງການລະລາຍ. ໂມເລກຸນນ້ ຳ (H2O) ມີໂຄງສ້າງທີ່ບໍ່ສະຫມໍ່າສະເຫມີດັ່ງນັ້ນມັນຄ້າຍຄືກັບແມ່ເຫຼັກ: ປາຍ ໜຶ່ງ ມີຄ່າໃຊ້ຈ່າຍໃນທາງບວກແລະອີກດ້ານ ໜຶ່ງ ມີຄ່າໃຊ້ຈ່າຍໃນທາງລົບ. ໃນເວລາທີ່ທ່ານເອົາສານປະສົມ ionic ລົງໃນນ້ ຳ, ແມ່ເຫຼັກເຫຼົ່ານີ້ "ເຕົ້າໂຮມ" ຢູ່ອ້ອມຕົວມັນ, ພະຍາຍາມດຶງເອົາໄອອອນບວກແລະລົບ.- ບາງທາດປະສົມທາດ ionic ບໍ່ຖືກດູດຊຶມ ແໜ້ນ, ພວກມັນຖືກພິຈາລະນາ ລະລາຍ ເພາະມັນຈະແຍກແລະລະລາຍໃນເວລາເພີ່ມເຂົ້າໃນນ້ ຳ. ທາດປະສົມອື່ນໆມີພັນທະບັດເຂັ້ມແຂງ ລະລາຍ ເນື່ອງຈາກວ່າໄອອອນໄດ້ຖືກດຶງດູດເອົາເຊິ່ງກັນແລະກັນຢ່າງ ແໜ້ນ ແຟ້ນໂດຍບໍ່ສົນເລື່ອງຂອງຄວາມດຶງດູດຂອງໂມເລກຸນນ້ ຳ.
- ທາດປະສົມບາງຢ່າງມີຜົນບັງຄັບໃຊ້ທຽບເທົ່າກັບຄວາມດຶງດູດຂອງໂມເລກຸນນ້ ຳ. ພວກເຂົາຖືກພິຈາລະນາ ລະລາຍເລັກນ້ອຍ ເພາະທາດປະສົມສ່ວນໃຫຍ່ຈະແຍກກັນ, ແຕ່ສ່ວນທີ່ເຫຼືອກໍ່ຈະຖືກດຶງດູດເຊິ່ງກັນແລະກັນ.

ເຂົ້າໃຈຫລັກການຂອງການລະລາຍ. ເນື່ອງຈາກວ່າປະຕິ ສຳ ພັນລະຫວ່າງອະຕອມມີຄວາມສັບສົນຫຼາຍ, ທ່ານບໍ່ສາມາດອີງໃສ່ສະຕິປັນຍາທັງ ໝົດ ເພື່ອ ຈຳ ແນກທາດໃດທີ່ສາມາດເຮັດໄດ້ຫຼືບໍ່ສາມາດເຮັດໄດ້. ຊອກຫາທາດໄອໂອທີ ທຳ ອິດໃນທາດປະສົມໃນບັນຊີລາຍຊື່ຂ້າງລຸ່ມນີ້ ສຳ ລັບຄຸນລັກສະນະ ທຳ ມະດາຂອງມັນ, ຫຼັງຈາກນັ້ນກວດເບິ່ງຂໍ້ຍົກເວັ້ນເພື່ອຮັບປະກັນວ່າທາດໄອໂອທີສອງບໍ່ມີປະຕິກິລິຍາຜິດປົກກະຕິກັບມັນ.- ຍົກຕົວຢ່າງ, ເພື່ອກວດສອບ strontium chloride (SrCl2), ກະລຸນາຊອກຫາ Sr ຫຼື Cl ໃນຂັ້ນຕອນທີ່ກ້າຫານຂ້າງລຸ່ມນີ້. Cl ແມ່ນ "ປົກກະຕິແລ້ວລະລາຍ" ດັ່ງນັ້ນກວດເບິ່ງຂໍ້ຍົກເວັ້ນຂ້າງລຸ່ມນີ້. Sr ບໍ່ໄດ້ຢູ່ໃນລາຍຊື່ຍົກເວັ້ນດັ່ງນັ້ນ SrCl2 ຈະຕ້ອງລະລາຍ.
- ຂໍ້ຍົກເວັ້ນທົ່ວໄປທີ່ສຸດຕໍ່ແຕ່ລະກົດແມ່ນຖືກຂຽນຢູ່ລຸ່ມກົດລະບຽບ. ມີຂໍ້ຍົກເວັ້ນອື່ນໆ, ແຕ່ວ່າສິ່ງເຫຼົ່ານີ້ຄົງຈະບໍ່ເກີດຂື້ນໃນເວລາເຄມີສາດຫຼືຊົ່ວໂມງທົດລອງ.

ທາດປະສົມແມ່ນລະລາຍໃນເວລາທີ່ມັນບັນຈຸໂລຫະທີ່ເປັນດ່າງເຊັ່ນ Li, Na, K, Rb ແລະ Cs. ໂລຫະເຫຼົ່ານີ້ຍັງຖືກເອີ້ນວ່າອົງປະກອບຂອງກຸ່ມ IA: lithium, sodium, potassium, rubidium ແລະ cesium. ເກືອບທັງ ໝົດ ທາດປະກອບທີ່ບັນຈຸທາດ ໜຶ່ງ ຂອງໄອອອນເຫຼົ່ານີ້ແມ່ນລະລາຍ.- ຂໍ້ຍົກເວັ້ນ: ລີ3ຕູ້ໄປສະນີ4 indissoluble.
ທາດປະສົມ NO3, ຄ2ຮ3ອ2, ບໍ່2, ClO3 ແລະ ClO4 ແມ່ນ soluble ທັງຫມົດ. ຊື່ທີ່ສອດຄ້ອງກັນກັບ ions ຂ້າງເທິງນີ້ແມ່ນ nitrate, acetate, nitrite, chlorate ແລະ perchlorate. ໃຫ້ສັງເກດວ່າອາເຊຕາຕິກມັກຈະຖືກຫຍໍ້ເປັນ OAc.
- ຂໍ້ຍົກເວັ້ນ: Ag (OAc) (acetate ເງິນ) ແລະ Hg (OAc)2 (mercury acetate) ບໍ່ລະລາຍ.
- AgNO2 ແລະ KClO4 ພຽງແຕ່ "ລະລາຍ ໜ້ອຍ ໜຶ່ງ" ເທົ່ານັ້ນ.
ທາດປະສົມຂອງ Cl, Br ແລະຂ້ອຍມັກຈະເປັນທາດລະລາຍ. ທາດ chlorine, Bromide ແລະທາດໄອໂອດີນເກືອບຈະປະກອບເປັນທາດປະສົມລະລາຍ, ເອີ້ນວ່າເກືອເກືອ halogen.
- ຂໍ້ຍົກເວັ້ນ: ຖ້າຫາກວ່າ ions ຂ້າງເທິງໃດ ໜຶ່ງ ປະສົມປະສານກັບເງິນ ions Ag, mercury Hg2, ຫຼື Pb lead, ຈະປະກອບເປັນທາດປະສົມທີ່ລະລາຍໄດ້. ສິ່ງດຽວກັນນີ້ແມ່ນ ສຳ ລັບທາດປະສົມທີ່ບໍ່ຄ່ອຍໄດ້ສ້າງຕັ້ງຂື້ນເມື່ອປະສົມກັບທອງແດງ Cu ແລະ thali Tl.
ທາດປະກອບທີ່ບັນຈຸ SO4 ປົກກະຕິແມ່ນລະລາຍ. ions ຊູນຟູຣິກມັກຈະປະກອບເປັນທາດປະສົມລະລາຍ, ແຕ່ມີຂໍ້ຍົກເວັ້ນຫຼາຍຢ່າງ.
- ຂໍ້ຍົກເວັ້ນ: ions Sulfate ປະກອບເປັນທາດປະສົມທີ່ບໍ່ລະລາຍກັບທາດໄອອອນຕໍ່ໄປນີ້: strontium Sr, barium Ba, lead Pb, ເງິນ Ag, calcium calcium, rad rad, ແລະອະຕອມເງິນຂອງ Ag2. ໃຫ້ສັງເກດວ່າ sulfate ເງິນແລະທາດການຊຽມຊັນມີພຽງແຕ່ລະດັບປານກາງ, ສະນັ້ນບາງຄົນຖືວ່າພວກມັນມີລະລາຍເລັກນ້ອຍ.
ສານທີ່ບັນຈຸ OH ຫຼື S ແມ່ນບໍ່ລະລາຍ. ຊື່ທີ່ສອດຄ້ອງກັນ ສຳ ລັບໄອອອນເຫຼົ່ານີ້ແມ່ນໄຮໂດຣລິກແລະ sulfide.
- ຂໍ້ຍົກເວັ້ນ: ທ່ານຈື່ໂລຫະທີ່ເປັນດ່າງ (ກຸ່ມ I-A) ແລະພວກມັນມັກສ້າງທາດປະສົມແນວໃດ? Li, Na, K, Rb ແລະ Cs ແມ່ນທາດປະກອບທັງ ໝົດ ທີ່ປະສົມກັບທາດ hydroxide ແລະທາດ sulfide. ນອກຈາກນັ້ນ, ໄຮໂດຼລິກກໍ່ສ້າງເປັນເກືອທີ່ລະລາຍກັບທາດໂລຫະໂລກທີ່ເປັນດ່າງ (ກຸ່ມ II-A): ແຄຊຽມ Ca, strontium Sr, ແລະບາບີນຽມ Ba. ໝາຍ ເຫດ: ທາດປະສົມທີ່ຜະລິດຈາກທາດໄຮໂດຼລິກແລະໂລຫະທີ່ເປັນດ່າງໃນຕົວຈິງມີ ຈຳ ນວນໂມເລກຸນທີ່ຍັງຄົງຜູກພັນກັນ, ສະນັ້ນບາງຄັ້ງມັນຖືກຖືວ່າເປັນ "ລະລາຍເລັກນ້ອຍ".
ທາດປະສົມທີ່ບັນຈຸ CO3 ຫຼື PO4 indissoluble. ກວດເບິ່ງຄັ້ງສຸດທ້າຍ ສຳ ລັບທາດຄາບອນຄາບອນແລະຟອສເຟດແລະທ່ານຈະເຫັນວ່າສານປະສົມຂອງທ່ານມີລະລາຍ.
- ຂໍ້ຍົກເວັ້ນ: ທາດໄອອອນເຫຼົ່ານີ້ແມ່ນທາດປະສົມທີ່ລະລາຍກັບໂລຫະທີ່ເປັນດ່າງເຊັ່ນ Li, Na, K, Rb ແລະ Cs, ເຊັ່ນດຽວກັນກັບທາດ Ammonium ion NH4.
ວິທີທີ່ 2 ຂອງ 2: ຄິດໄລ່ການລະລາຍຈາກ K ຄົງທີ່sp
ຊອກຫາຜະລິດຕະພັນລະລາຍຄົງທີ່ Ksp. ຄົງທີ່ນີ້ແມ່ນແຕກຕ່າງກັນ ສຳ ລັບແຕ່ລະປະສົມ, ດັ່ງນັ້ນທ່ານຄວນຊອກຫາມັນຢູ່ໃນເສັ້ນສະແດງໃນປື້ມ ຕຳ ລາຮຽນຫຼື online. ເນື່ອງຈາກຄຸນຄ່າເຫລົ່ານີ້ຖືກ ກຳ ນົດດ້ວຍການທົດລອງແລະສາມາດແຕກຕ່າງກັນຫຼາຍລະຫວ່າງກາຟ, ມັນເປັນສິ່ງທີ່ດີທີ່ສຸດທີ່ຈະ ນຳ ໃຊ້ກາຟຂອງປື້ມ ຕຳ ລາຮຽນຖ້າມີ. ເວັ້ນເສຍແຕ່ໄດ້ລະບຸໄວ້ເປັນຢ່າງອື່ນ, ພື້ນທີ່ສ່ວນໃຫຍ່ສົມມຸດອຸນຫະພູມທົດສອບ25ºC.
- ຍົກຕົວຢ່າງ, ໃຫ້ເວົ້າວ່າທ່ານ ກຳ ລັງລະລາຍທາດທາດໄອໂອດິນ ນຳ ດ້ວຍສູດ PbI2, ຂຽນຜະລິດຕະພັນລະລາຍຄົງທີ່ຂອງມັນ. ຖ້າທ່ານ ໝາຍ ເຖິງເສັ້ນສະແດງທີ່ bilbo.chm.uri.edu ຫຼັງຈາກນັ້ນ, ທ່ານຈະ ນຳ ໃຊ້ຄົງທີ່ 7,1 × 10.
ຂຽນສົມຜົນທາງເຄມີ. ທຳ ອິດ, ກຳ ນົດຮູບແບບການແຍກທາດ ionic ຂອງທາດປະສົມນີ້ເມື່ອລະລາຍ. ຈາກນັ້ນຂຽນສົມຜົນກັບ Ksp ດ້ານ ໜຶ່ງ ແລະສ່ວນປະກອບໄອອອນໃນອີກດ້ານ ໜຶ່ງ.
- ຍົກຕົວຢ່າງ, ໂມເລກຸນ PbI2 ແຍກອອກເປັນ ions Pb, I, ແລະ I. (ທ່ານພຽງແຕ່ຕ້ອງການຮູ້ຫຼືກວດສອບການຮັບຜິດຊອບຂອງທາດໄອອອນ, ເນື່ອງຈາກວ່າທາດປະສົມທັງ ໝົດ ແມ່ນມີໄຟຟ້າເປັນກາງຕະຫຼອດເວລາ).
- ຂຽນສົມຜົນ 7,1 × 10 =
- ສົມຜົນນີ້ແມ່ນຄວາມຄົງທີ່ຂອງການລະລາຍ, ທ່ານສາມາດຊອກຫາ 2 ions ໃນຕາຕະລາງການລະລາຍ. ເນື່ອງຈາກມີ 2 ສະບັບ, l- ຕ້ອງເປັນສີ່ຫລ່ຽມ.
ປ່ຽນສະມະການເພື່ອໃຊ້ຕົວແປ. ຂຽນ ໃໝ່ ສົມຜົນໂດຍໃຊ້ວິທີການກ່ຽວກັບພຶດຊະຄະນິດ ທຳ ມະດາ, ໂດຍ ນຳ ໃຊ້ຂໍ້ມູນທີ່ທ່ານຮູ້ກ່ຽວກັບ ຈຳ ນວນໂມເລກຸນແລະໄອອອນ. ກຳ ນົດ x ເທົ່າກັບມວນສານຂອງທາດປະສົມທີ່ຈະລະລາຍ, ແລະຂຽນສົມຜົນ ໃໝ່ ທີ່ x ສະແດງ ຈຳ ນວນຂອງແຕ່ລະທາດ ion.
- ໃນຕົວຢ່າງນີ້, ພວກເຮົາ ຈຳ ເປັນຕ້ອງຂຽນ ໃໝ່ ສົມຜົນ 7,1 × 10 =
- ເນື່ອງຈາກວ່າມີພຽງແຕ່ທາດໄອອອນ (Pb) ໃນສານປະສົມ, ຈຳ ນວນໂມເລກຸນທີ່ລະລາຍແມ່ນເທົ່າກັບ ຈຳ ນວນຂອງທາດ ນຳ ້ອິດສະຫຼະ. ດັ່ງນັ້ນພວກເຮົາສາມາດຕັ້ງຄ່າມັນເປັນ x.
- ຍ້ອນວ່າມັນມີທາດໄອໂອດິນ 2 ຊະນິດ (I) ສຳ ລັບທາດໄອໂອດິນ ນຳ ແຕ່ລະຕົວ, ພວກເຮົາໄດ້ ກຳ ນົດ ຈຳ ນວນທາດປະສົມທາດໄອໂອດິນເທົ່າກັບ 2 ເທົ່າ.
- ດຽວນີ້ສົມຜົນກາຍເປັນ 7.1 × 10 = (x) (2 ເທົ່າ)
ຄຳ ນຶງເຖິງບັນດາ ions ທຳ ມະດາ, ຖ້າມີ. ຂ້າມຂັ້ນຕອນນີ້ຖ້າທ່ານ ກຳ ລັງລະລາຍທາດປະສົມໃນນ້ ຳ ກັ່ນ. ຖ້າສານປະສົມຖືກລະລາຍໃນວິທີແກ້ໄຂທີ່ມີສ່ວນປະກອບສ່ວນ ໜຶ່ງ ຂອງອົງປະກອບໄອຊີສ່ວນ ໜຶ່ງ ຫຼືຫຼາຍຊະນິດ ("ion ທົ່ວໄປ"), ການລະລາຍຂອງສານປະສົມຈະຫຼຸດລົງຢ່າງຫຼວງຫຼາຍ. ຜົນກະທົບຂອງໄອອອນທົ່ວໄປຈະເຫັນໄດ້ຊັດເຈນທີ່ສຸດກ່ຽວກັບທາດປະສົມທີ່ບໍ່ສາມາດລະລາຍໄດ້, ແລະໃນກໍລະນີນີ້ທ່ານສາມາດສົມມຸດວ່າສ່ວນໃຫຍ່ຂອງໄອອອນທີ່ມີຄວາມສົມດຸນແມ່ນສິ່ງທີ່ເຄີຍມີມາກ່ອນໃນການແກ້ໄຂ. ຂຽນ ໃໝ່ ສົມຜົນເພື່ອຄິດໄລ່ຄວາມເຂັ້ມຂົ້ນຂອງໂມຣາມ (mol ຕໍ່ລິດຫຼື M) ຂອງ ion ທີ່ມີຢູ່ໃນວິທີແກ້ໄຂແລ້ວ, ປ່ຽນແທນຄ່ານີ້ກັບຕົວແປ x ທີ່ທ່ານໃຊ້ ສຳ ລັບທາດໄອອອນນັ້ນ.
- ຍົກຕົວຢ່າງ, ຖ້າທາດປະສົມທາດໄອໂອດີນຖືກລະລາຍໃນການແກ້ໄຂບັນຫາ chloride lead 0.2M (PbCl)2), ພວກເຮົາຈະຂຽນ ໃໝ່ ສົມຜົນເປັນ 7.1 × 10 = (0.2M + x) (2 ເທົ່າ). ເນື່ອງຈາກ 0.2M ແມ່ນຄວາມເຂັ້ມຂົ້ນສູງກ່ວາ x, ພວກເຮົາສາມາດຂຽນມັນຄືນ ໃໝ່ ເປັນ 7.1 × 10 = (0.2M) (2 ເທົ່າ).
ແກ້ສົມຜົນ. ແກ້ໄຂ ສຳ ລັບ x, ແລະທ່ານຈະເຫັນການລະລາຍຂອງສານປະສົມ. ໃນ ຄຳ ນິຍາມຂອງການລະລາຍຄົງທີ່, ທ່ານຕ້ອງຂຽນ ຄຳ ຕອບຂອງທ່ານໃນແງ່ຂອງ ຈຳ ນວນໂມ້ຂອງທາດປະສົມທີ່ລະລາຍຕໍ່ນ້ ຳ ໜຶ່ງ ລິດ. ທ່ານອາດຈະຕ້ອງໃຊ້ຄອມພິວເຕີຂອງທ່ານເພື່ອຊອກຫາ ຄຳ ຕອບສຸດທ້າຍ.
- ຕົວຢ່າງຕໍ່ໄປນີ້ແມ່ນການລະລາຍໃນນ້ ຳ ກັ່ນໂດຍບໍ່ມີໄອອອນ ທຳ ມະດາ.
- 7.1 × 10 = (x) (2 ເທົ່າ)
- 7.1 × 10 = (x) (4 ເທົ່າ)
- 7.1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 moles ຕໍ່ລິດຈະລະລາຍ. ນີ້ແມ່ນມະຫາຊົນທີ່ມີຂະ ໜາດ ນ້ອຍຫຼາຍ, ສະນັ້ນທາດປະສົມນີ້ເກືອບຈະບໍ່ສາມາດລະລາຍໄດ້.
ເຈົ້າຕ້ອງການຫັຍງ
- ຕາຕະລາງການລະລາຍຂອງຜະລິດຕະພັນຄົງທີ່ຂອງສານປະສົມ (K. K)sp)
ຄຳ ແນະ ນຳ
- ຖ້າທ່ານມີຂໍ້ມູນທົດລອງກ່ຽວກັບປະລິມານທາດທີ່ລະລາຍ, ທ່ານສາມາດໃຊ້ສົມຜົນດຽວກັນເພື່ອແກ້ໄຂ ສຳ ລັບການລະລາຍຄົງທີ່ K.sp.
ຄຳ ເຕືອນ
- ບໍ່ມີຄວາມເປັນເອກະສັນກັນກ່ຽວກັບ ຄຳ ນິຍາມຂອງຂໍ້ ກຳ ນົດເຫຼົ່ານີ້, ແຕ່ນັກເຄມີສາດເຫັນດີ ນຳ ສ່ວນປະກອບສ່ວນໃຫຍ່. ທາດປະສົມພິເສດ ຈຳ ນວນ ໜຶ່ງ ເຊິ່ງທັງໂມເລກຸນລະລາຍແລະລະລາຍບໍ່ມີສ່ວນປະກອບທີ່ ສຳ ຄັນ, ແຕ່ລະອັນມີ ຄຳ ອະທິບາຍທີ່ແຕກຕ່າງກັນຂອງທາດປະສົມເຫຼົ່ານີ້.
- ປື້ມ ຕຳ ລາເກົ່າ ຈຳ ນວນ ໜຶ່ງ ເຫັນ NH4OH ແມ່ນສານປະສົມລະລາຍ. ນີ້ບໍ່ແມ່ນຄວາມຈິງ; ການກວດພົບ ຈຳ ນວນ ໜ້ອຍໆ ຂອງ NH ions4 ແລະ OH ແຕ່ສອງທາດນີ້ບໍ່ສາມາດປະສົມເຂົ້າກັນເປັນທາດປະສົມໄດ້.