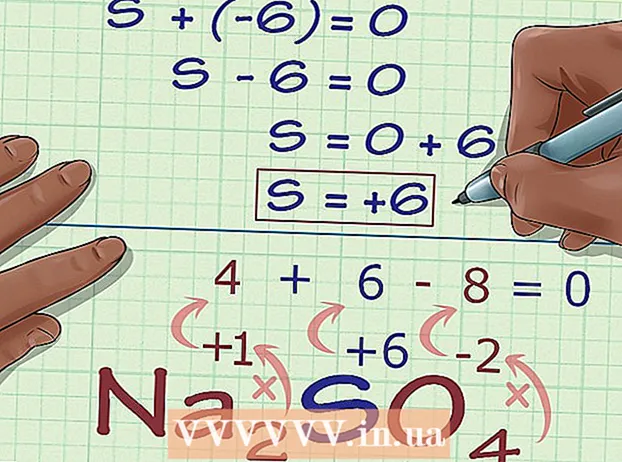
ເນື້ອຫາ
- ເພື່ອກ້າວ
- ສ່ວນທີ 1 ຂອງ 2: ກຳ ນົດຕົວເລກການຜຸພັງໂດຍອີງໃສ່ກົດລະບຽບທາງເຄມີ
- ສ່ວນທີ 2 ຂອງ 2: ການມອບ ໝາຍ ເລກໃຫ້ກັບອະຕອມໂດຍບໍ່ມີກົດລະບຽບ ສຳ ລັບຕົວເລກການຜຸພັງ
- ຄຳ ແນະ ນຳ
- ຄວາມ ຈຳ ເປັນ
ໃນວິຊາເຄມີສາດ, ຄຳ ວ່າ "ການຜຸພັງ" ແລະ "ການຫຼຸດຜ່ອນ" ໝາຍ ເຖິງປະຕິກິລິຍາເຫຼົ່ານັ້ນທີ່ອະຕອມ (ຫລືກຸ່ມຂອງອະຕອມ) ສູນເສຍຫຼືໄດ້ຮັບຜົນປະໂຫຍດຈາກເອເລັກໂຕຣນິກຕາມ ລຳ ດັບ. ຕົວເລກການຜຸພັງແມ່ນຕົວເລກທີ່ຖືກມອບ ໝາຍ ໃຫ້ກັບອະຕອມ (ຫລືກຸ່ມຂອງອະຕອມ) ເພື່ອຊ່ວຍນັກເຄມີສາດໃນການຄວບຄຸມ ຈຳ ນວນອິເລັກຕອນທີ່ມີການເຄື່ອນຍ້າຍແລະບໍ່ວ່າຈະໃຫ້ທາດປະຕິກອນປະຕິກິລິຍາອອກຊິເດຊັນຫລືຫຼຸດຜ່ອນໃນເວລາປະຕິກິລິຍາ. ຂັ້ນຕອນໃນການມອບ ໝາຍ ເລກການຜຸພັງໃຫ້ກັບອາຕອມສາມາດຕັ້ງແຕ່ງ່າຍດາຍຈົນສັບສົນຫຼາຍ, ຂື້ນກັບການຮັບຜິດຊອບຂອງອະຕອມແລະອົງປະກອບທາງເຄມີຂອງໂມເລກຸນເຊິ່ງມັນເປັນສ່ວນ ໜຶ່ງ. ເພື່ອເຮັດໃຫ້ສິ່ງຕ່າງໆສັບສົນຂື້ນ, ບາງປະລໍາມະນູສາມາດມີຕົວເລກການຜຸພັງຫຼາຍ. ໂຊກດີ, ການແຕ່ງຕັ້ງຕົວເລກການຜຸພັງແມ່ນຖືກຄວບຄຸມໂດຍກົດລະບຽບທີ່ໄດ້ ກຳ ນົດຢ່າງຈະແຈ້ງ, ງ່າຍຕໍ່ການປະຕິບັດ, ແຕ່ຄວາມເຂົ້າໃຈຂັ້ນພື້ນຖານກ່ຽວກັບເຄມີແລະພຶດຊະຄະນິດຈະເຮັດໃຫ້ການ ນຳ ໃຊ້ກົດລະບຽບເຫລົ່ານີ້ງ່າຍຂຶ້ນຫຼາຍ.
ເພື່ອກ້າວ
ສ່ວນທີ 1 ຂອງ 2: ກຳ ນົດຕົວເລກການຜຸພັງໂດຍອີງໃສ່ກົດລະບຽບທາງເຄມີ
 ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມແມ່ນສ່ວນປະກອບ. ປະລໍາມະນູທີ່ບໍ່ມີອິດສະຫຼະແລະບໍ່ມີຂອບເຂດສະເຫມີມີຈໍານວນການຜຸພັງຂອງ 0. ນີ້ແມ່ນຄວາມຈິງສໍາລັບທັງສອງປະລໍາມະນູທີ່ປະກອບດ້ວຍປະລໍາມະນູດຽວແລະປະລໍາມະນູທີ່ຮູບແບບຂອງມັນແມ່ນ diatomic ຫຼື polyatomic.
ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມແມ່ນສ່ວນປະກອບ. ປະລໍາມະນູທີ່ບໍ່ມີອິດສະຫຼະແລະບໍ່ມີຂອບເຂດສະເຫມີມີຈໍານວນການຜຸພັງຂອງ 0. ນີ້ແມ່ນຄວາມຈິງສໍາລັບທັງສອງປະລໍາມະນູທີ່ປະກອບດ້ວຍປະລໍາມະນູດຽວແລະປະລໍາມະນູທີ່ຮູບແບບຂອງມັນແມ່ນ diatomic ຫຼື polyatomic. - ຍົກຕົວຢ່າງ, Al(s) ແລະ Cl2 ທັງສອງມີ ຈຳ ນວນການຜຸພັງ 0 ເພາະວ່າມັນບໍ່ແມ່ນທາດປະສົມ.
- ໃຫ້ສັງເກດວ່າຊູນຟູຣິກໃນຮູບແບບອົງປະກອບຂອງມັນ, S.8 (octasulfur), ເຖິງແມ່ນວ່າສະຫມໍ່າສະເຫມີ, ຍັງມີຈໍານວນການຜຸພັງຂອງ 0.
 ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມແມ່ນທາດໄອອອນ. Ions ມີຕົວເລກການຜຸພັງເທົ່າກັບຄ່າບໍລິການຂອງພວກເຂົາ. ນີ້ແມ່ນຄວາມຈິງຂອງບັນຫາ ions ທີ່ບໍ່ມີການຜູກມັດເຊັ່ນດຽວກັນກັບ ion ທີ່ເປັນສ່ວນ ໜຶ່ງ ຂອງທາດປະສົມ ion.
ກຳ ນົດວ່າສານທີ່ຢູ່ໃນ ຄຳ ຖາມແມ່ນທາດໄອອອນ. Ions ມີຕົວເລກການຜຸພັງເທົ່າກັບຄ່າບໍລິການຂອງພວກເຂົາ. ນີ້ແມ່ນຄວາມຈິງຂອງບັນຫາ ions ທີ່ບໍ່ມີການຜູກມັດເຊັ່ນດຽວກັນກັບ ion ທີ່ເປັນສ່ວນ ໜຶ່ງ ຂອງທາດປະສົມ ion. - ຍົກຕົວຢ່າງ, ion Cl ມີຕົວເລກການຜຸພັງຂອງ -1.
- The Cl ion ຍັງມີຢູ່ ຈໍານວນການຜຸພັງຂອງ -1 ເມື່ອມັນເປັນສ່ວນຫນຶ່ງຂອງສານປະສົມ NaCl. ເນື່ອງຈາກ Na ion, ຕາມ ຄຳ ນິຍາມ, ມີຄ່າໃຊ້ຈ່າຍຂອງ +1, ພວກເຮົາຮູ້ວ່າ Cl ion ມີຄ່າບໍລິການ -1, ດັ່ງນັ້ນ ຈຳ ນວນການຜຸພັງແມ່ນຍັງ -1.
 ໃນກໍລະນີຂອງ ions ໂລຫະ, ມັນເປັນການດີທີ່ຈະຈື່ວ່າຕົວເລກການຜຸພັງຫຼາຍແມ່ນເປັນໄປໄດ້. ໂລຫະຫຼາຍຊະນິດສາມາດມີທີ່ດິນຫຼາຍກ່ວາ ໜຶ່ງ ຄັນ. ຍົກຕົວຢ່າງ, ທາດເຫຼັກໂລຫະ (Fe) ສາມາດເປັນທາດ ion ທີ່ມີຄ່າໃຊ້ຈ່າຍ +2 ຫຼື +3. ການຮັບຜິດຊອບຂອງທາດໂລຫະ (ແລະດັ່ງນັ້ນຕົວເລກການຜຸພັງຂອງພວກມັນ) ສາມາດຖືກ ກຳ ນົດໃນການພົວພັນກັບການຮັບຜິດຊອບຂອງອະຕອມອື່ນໆໃນສ່ວນປະກອບຂອງສ່ວນທີ່ພວກມັນເປັນສ່ວນ ໜຶ່ງ, ຫຼື, ເມື່ອຂຽນເປັນຂໍ້ຄວາມ, ໂດຍການສັງເກດໃນຕົວເລກໂລມັນ (ເຊັ່ນວ່າໃນ ປະໂຫຍກ: "ທາດເຫຼັກ (III) ທາດເຫຼັກມີຄ່າໃຊ້ຈ່າຍຂອງ +3.").
ໃນກໍລະນີຂອງ ions ໂລຫະ, ມັນເປັນການດີທີ່ຈະຈື່ວ່າຕົວເລກການຜຸພັງຫຼາຍແມ່ນເປັນໄປໄດ້. ໂລຫະຫຼາຍຊະນິດສາມາດມີທີ່ດິນຫຼາຍກ່ວາ ໜຶ່ງ ຄັນ. ຍົກຕົວຢ່າງ, ທາດເຫຼັກໂລຫະ (Fe) ສາມາດເປັນທາດ ion ທີ່ມີຄ່າໃຊ້ຈ່າຍ +2 ຫຼື +3. ການຮັບຜິດຊອບຂອງທາດໂລຫະ (ແລະດັ່ງນັ້ນຕົວເລກການຜຸພັງຂອງພວກມັນ) ສາມາດຖືກ ກຳ ນົດໃນການພົວພັນກັບການຮັບຜິດຊອບຂອງອະຕອມອື່ນໆໃນສ່ວນປະກອບຂອງສ່ວນທີ່ພວກມັນເປັນສ່ວນ ໜຶ່ງ, ຫຼື, ເມື່ອຂຽນເປັນຂໍ້ຄວາມ, ໂດຍການສັງເກດໃນຕົວເລກໂລມັນ (ເຊັ່ນວ່າໃນ ປະໂຫຍກ: "ທາດເຫຼັກ (III) ທາດເຫຼັກມີຄ່າໃຊ້ຈ່າຍຂອງ +3."). - ຍົກຕົວຢ່າງ, ໃຫ້ພິຈາລະນາຢ່າງໃກ້ຊິດກ່ຽວກັບສານປະສົມທີ່ປະກອບດ້ວຍທາດອະລູມີນຽມ. ທາດປະສົມ AlCl3 ມີຄ່າບໍລິການ 0. ເພາະວ່າພວກເຮົາຮູ້ວ່າ Cl ions ມີຄ່າບໍລິການ -1 ແລະ 3 Cl ions ມີຢູ່ໃນສານປະສົມ, Al-ion ຕ້ອງມີຄ່າໃຊ້ຈ່າຍຂອງ +3, ດັ່ງນັ້ນຄ່າໃຊ້ຈ່າຍຂອງ ions ທັງ ໝົດ ທີ່ເພີ່ມເຂົ້າກັນແມ່ນ .. ດັ່ງນັ້ນ, ຕົວເລກການຜຸພັງຂອງ Al ແມ່ນ +3.
 ມອບ ໝາຍ ຈຳ ນວນການຜຸພັງໃຫ້ -2 ໃຫ້ອົກຊີເຈນ (ມີຂໍ້ຍົກເວັ້ນ). ໃນ ເກືອບທັງຫມົດ ໃນທຸກໆກໍລະນີ, ປະລໍາມະນູອົກຊີເຈນມີຈໍານວນການຜຸພັງຂອງ -2. ມີຂໍ້ຍົກເວັ້ນ ໜ້ອຍ ໜຶ່ງ ຕໍ່ກົດລະບຽບນີ້:
ມອບ ໝາຍ ຈຳ ນວນການຜຸພັງໃຫ້ -2 ໃຫ້ອົກຊີເຈນ (ມີຂໍ້ຍົກເວັ້ນ). ໃນ ເກືອບທັງຫມົດ ໃນທຸກໆກໍລະນີ, ປະລໍາມະນູອົກຊີເຈນມີຈໍານວນການຜຸພັງຂອງ -2. ມີຂໍ້ຍົກເວັ້ນ ໜ້ອຍ ໜຶ່ງ ຕໍ່ກົດລະບຽບນີ້: - ເມື່ອອົກຊີຢູ່ໃນສະພາບເດີມ (O2), ຫຼັງຈາກນັ້ນຕົວເລກການຜຸພັງແມ່ນເທົ່າກັບ 0, ເຊິ່ງເປັນກໍລະນີ ສຳ ລັບທຸກໆປະລໍາມະນູຂອງປະຖົມ.
- ເມື່ອອົກຊີເຈນເປັນສ່ວນ ໜຶ່ງ ຂອງ peroxide, ຫຼັງຈາກນັ້ນຕົວເລກການຜຸພັງແມ່ນ -1. Peroxides ແມ່ນຊັ້ນຂອງທາດປະສົມທີ່ມີທາດອົກຊີເຈນທີ່ມີອົກຊີເຈນ (ຫລືທາດ peroxide anion O)2). ຍົກຕົວຢ່າງ, ໃນໂມເລກຸນ H2ອ2 (hydrogen peroxide), ອົກຊີເຈນມີຕົວເລກການຜຸພັງ (ແລະຄ່າໃຊ້ຈ່າຍ) ຂອງ -1Also, ໃນເວລາທີ່ອົກຊີເຈນແມ່ນສ່ວນຫນຶ່ງຂອງ superoxide, ຈໍານວນການຜຸພັງແມ່ນ -0.5.
- ເມື່ອອົກຊີເຈນຖືກຜູກກັບ fluorine, ຕົວເລກການຜຸພັງແມ່ນ +2. ເບິ່ງກົດລະບຽບຂອງ fluor ຂ້າງລຸ່ມນີ້ ສຳ ລັບຂໍ້ມູນເພີ່ມເຕີມ. ໃນ (O2ຟ.2) ນີ້ແມ່ນ +1.
 ກໍານົດຈໍານວນການຜຸພັງຂອງ +1 ກັບ hydrogen (ມີຂໍ້ຍົກເວັ້ນ). ເຊັ່ນດຽວກັນກັບອົກຊີເຈນ, ຈໍານວນການຜຸພັງຂອງ hydrogen ແມ່ນຂື້ນກັບກໍລະນີທີ່ມີການຍົກເວັ້ນ. ໂດຍທົ່ວໄປ, ໄຮໂດເຈນມີຕົວເລກການຜຸພັງ +1 (ຍົກເວັ້ນໃນຮູບແບບອົງປະກອບ, H.2). ແຕ່ໃນກໍລະນີຂອງສານປະສົມພິເສດທີ່ເອີ້ນວ່າການປະສົມ, hydrogen ມີ ຈຳ ນວນການຜຸພັງຂອງ -1.
ກໍານົດຈໍານວນການຜຸພັງຂອງ +1 ກັບ hydrogen (ມີຂໍ້ຍົກເວັ້ນ). ເຊັ່ນດຽວກັນກັບອົກຊີເຈນ, ຈໍານວນການຜຸພັງຂອງ hydrogen ແມ່ນຂື້ນກັບກໍລະນີທີ່ມີການຍົກເວັ້ນ. ໂດຍທົ່ວໄປ, ໄຮໂດເຈນມີຕົວເລກການຜຸພັງ +1 (ຍົກເວັ້ນໃນຮູບແບບອົງປະກອບ, H.2). ແຕ່ໃນກໍລະນີຂອງສານປະສົມພິເສດທີ່ເອີ້ນວ່າການປະສົມ, hydrogen ມີ ຈຳ ນວນການຜຸພັງຂອງ -1. - ຍົກຕົວຢ່າງ, ຈາກ H2ໂອ້, ພວກເຮົາຮູ້ວ່າໄຮໂດເຈນມີ ຈຳ ນວນຜຸພັງ +1 ເພາະວ່າອົກຊີເຈນມີຄ່າ -2 ແລະພວກເຮົາຕ້ອງການຄ່າບໍລິການ 2 +1 ເພື່ອເຮັດການປະສົມທີ່ມີຄ່າທັງ ໝົດ ຂອງສູນ. ແຕ່ດ້ວຍທາດ sodium hydride, NaH, hydrogen ມີ ຈຳ ນວນການຜຸພັງ -1 ເພາະວ່າທາດ Na Na ມີຄ່າໃຊ້ຈ່າຍ +1 ແລະ, ເພື່ອເຮັດໃຫ້ການຄິດໄລ່ຂອງສານປະສົມທັງ ໝົດ 0, hydrogen ມີຄ່າບໍລິການ (ແລະດັ່ງນັ້ນ ຈຳ ນວນການຜຸພັງ) -1 -1.
 fluorine ສະເຫມີ ຈໍານວນການຜຸພັງຂອງ -1. ດັ່ງທີ່ໄດ້ລະບຸໄວ້ຂ້າງເທິງ, ຕົວເລກການຜຸພັງຂອງອົງປະກອບສະເພາະໃດຫນຶ່ງສາມາດແຕກຕ່າງກັນຍ້ອນປັດໃຈຕ່າງໆ (ທາດໂລຫະ, ອະຕອມອົກຊີໃນ peroxides, ແລະອື່ນໆ). ໃນທາງກົງກັນຂ້າມ, fluorine ມີຈໍານວນຜຸພັງຂອງ -1, ແລະວ່າບໍ່ເຄີຍປ່ຽນແປງ. ນີ້ແມ່ນຍ້ອນວ່າ fluorine ແມ່ນອົງປະກອບທີ່ບໍ່ມີໄຟຟ້າຫຼາຍທີ່ສຸດ, ຫຼືເວົ້າອີກຢ່າງ ໜຶ່ງ, ມັນແມ່ນອົງປະກອບທີ່ບໍ່ເຕັມໃຈທີ່ຈະປ່ອຍເອເລັກໂຕຣນິກແລະສ່ວນຫຼາຍຈະຮັບເອົາເອເລັກໂຕຣນິກຈາກອາຕອມອື່ນໆ. ດັ່ງນັ້ນ, ຈຳ ນວນການຜຸພັງຈະບໍ່ປ່ຽນແປງ.
fluorine ສະເຫມີ ຈໍານວນການຜຸພັງຂອງ -1. ດັ່ງທີ່ໄດ້ລະບຸໄວ້ຂ້າງເທິງ, ຕົວເລກການຜຸພັງຂອງອົງປະກອບສະເພາະໃດຫນຶ່ງສາມາດແຕກຕ່າງກັນຍ້ອນປັດໃຈຕ່າງໆ (ທາດໂລຫະ, ອະຕອມອົກຊີໃນ peroxides, ແລະອື່ນໆ). ໃນທາງກົງກັນຂ້າມ, fluorine ມີຈໍານວນຜຸພັງຂອງ -1, ແລະວ່າບໍ່ເຄີຍປ່ຽນແປງ. ນີ້ແມ່ນຍ້ອນວ່າ fluorine ແມ່ນອົງປະກອບທີ່ບໍ່ມີໄຟຟ້າຫຼາຍທີ່ສຸດ, ຫຼືເວົ້າອີກຢ່າງ ໜຶ່ງ, ມັນແມ່ນອົງປະກອບທີ່ບໍ່ເຕັມໃຈທີ່ຈະປ່ອຍເອເລັກໂຕຣນິກແລະສ່ວນຫຼາຍຈະຮັບເອົາເອເລັກໂຕຣນິກຈາກອາຕອມອື່ນໆ. ດັ່ງນັ້ນ, ຈຳ ນວນການຜຸພັງຈະບໍ່ປ່ຽນແປງ.  ຕົວເລກການຜຸພັງໃນສານປະສົມແມ່ນເທົ່າກັບການຮັບຜິດຊອບຂອງສານປະສົມ. ຕົວເລກການຜຸພັງຂອງປະລໍາມະນູທັງ ໝົດ ໃນສານປະສົມແມ່ນເທົ່າກັບການຮັບຜິດຊອບຂອງສານປະສົມນັ້ນ. ຍົກຕົວຢ່າງ, ຖ້າສານປະສົມບໍ່ມີຄ່າໃຊ້ຈ່າຍ, ລວມຍອດ ຈຳ ນວນການຜຸພັງທັງ ໝົດ ຈະເປັນສູນ; ຖ້າສານປະສົມແມ່ນທາດໂພລິເມີໂທນທີ່ຮັບຜິດຊອບ -1, ຫຼັງຈາກນັ້ນຕົວເລກການຜຸພັງເພີ່ມຈະຕ້ອງເປັນ -1, etc.
ຕົວເລກການຜຸພັງໃນສານປະສົມແມ່ນເທົ່າກັບການຮັບຜິດຊອບຂອງສານປະສົມ. ຕົວເລກການຜຸພັງຂອງປະລໍາມະນູທັງ ໝົດ ໃນສານປະສົມແມ່ນເທົ່າກັບການຮັບຜິດຊອບຂອງສານປະສົມນັ້ນ. ຍົກຕົວຢ່າງ, ຖ້າສານປະສົມບໍ່ມີຄ່າໃຊ້ຈ່າຍ, ລວມຍອດ ຈຳ ນວນການຜຸພັງທັງ ໝົດ ຈະເປັນສູນ; ຖ້າສານປະສົມແມ່ນທາດໂພລິເມີໂທນທີ່ຮັບຜິດຊອບ -1, ຫຼັງຈາກນັ້ນຕົວເລກການຜຸພັງເພີ່ມຈະຕ້ອງເປັນ -1, etc. - ນີ້ແມ່ນວິທີທີ່ດີທີ່ຈະກວດສອບ ຄຳ ຕອບຂອງທ່ານ - ຖ້າການເພີ່ມ ຈຳ ນວນການຜຸພັງຂອງສານປະສົມບໍ່ເທົ່າກັບຄ່າບໍລິການຂອງສານປະສົມນັ້ນ, ທ່ານຈະຮູ້ວ່າທ່ານໄດ້ເຮັດຜິດ.
ສ່ວນທີ 2 ຂອງ 2: ການມອບ ໝາຍ ເລກໃຫ້ກັບອະຕອມໂດຍບໍ່ມີກົດລະບຽບ ສຳ ລັບຕົວເລກການຜຸພັງ
 ຊອກຫາປະລໍາມະນູໂດຍບໍ່ມີກົດລະບຽບການຜຸພັງ. ບາງປະລໍາມະນູບໍ່ປະຕິບັດຕາມກົດລະບຽບໃນການຊອກຫາຕົວເລກການຜຸພັງ. ຖ້າອະຕອມບໍ່ປະຕິບັດຕາມກົດລະບຽບຂ້າງເທິງນີ້ແລະທ່ານບໍ່ແນ່ໃຈວ່າຄ່າໃຊ້ຈ່າຍຂອງມັນແມ່ນຫຍັງ (ຕົວຢ່າງ: ຖ້າມັນເປັນສ່ວນ ໜຶ່ງ ຂອງສານປະສົມທີ່ໃຫຍ່ກວ່າເພື່ອໃຫ້ຄ່າບໍລິການສ່ວນບຸກຄົນບໍ່ຮູ້), ທ່ານສາມາດຊອກຫາຕົວເລກການຜຸພັງຂອງອະຕອມນັ້ນໂດຍ ການລົບລ້າງ. ທຳ ອິດທ່ານ ກຳ ນົດວ່າການຜຸພັງແມ່ນຫຍັງຂອງທຸກປະລໍາມະນູອື່ນໆທີ່ຢູ່ໃນສານປະສົມ. ຫຼັງຈາກນັ້ນທ່ານແກ້ບັນຫາ ສຳ ລັບສິ່ງທີ່ບໍ່ຮູ້ຈັກໃນສົມຜົນ, ໂດຍອີງໃສ່ຄ່າ ທຳ ນຽມທັງ ໝົດ ຂອງສານປະສົມ.
ຊອກຫາປະລໍາມະນູໂດຍບໍ່ມີກົດລະບຽບການຜຸພັງ. ບາງປະລໍາມະນູບໍ່ປະຕິບັດຕາມກົດລະບຽບໃນການຊອກຫາຕົວເລກການຜຸພັງ. ຖ້າອະຕອມບໍ່ປະຕິບັດຕາມກົດລະບຽບຂ້າງເທິງນີ້ແລະທ່ານບໍ່ແນ່ໃຈວ່າຄ່າໃຊ້ຈ່າຍຂອງມັນແມ່ນຫຍັງ (ຕົວຢ່າງ: ຖ້າມັນເປັນສ່ວນ ໜຶ່ງ ຂອງສານປະສົມທີ່ໃຫຍ່ກວ່າເພື່ອໃຫ້ຄ່າບໍລິການສ່ວນບຸກຄົນບໍ່ຮູ້), ທ່ານສາມາດຊອກຫາຕົວເລກການຜຸພັງຂອງອະຕອມນັ້ນໂດຍ ການລົບລ້າງ. ທຳ ອິດທ່ານ ກຳ ນົດວ່າການຜຸພັງແມ່ນຫຍັງຂອງທຸກປະລໍາມະນູອື່ນໆທີ່ຢູ່ໃນສານປະສົມ. ຫຼັງຈາກນັ້ນທ່ານແກ້ບັນຫາ ສຳ ລັບສິ່ງທີ່ບໍ່ຮູ້ຈັກໃນສົມຜົນ, ໂດຍອີງໃສ່ຄ່າ ທຳ ນຽມທັງ ໝົດ ຂອງສານປະສົມ. - ຍົກຕົວຢ່າງ, ໃນທາດປະສົມ Na2ສະນັ້ນ4, ຄ່າໃຊ້ຈ່າຍຂອງຊູນຟູຣິກ (S) ແມ່ນບໍ່ຮູ້ - ມັນບໍ່ແມ່ນໃນຮູບແບບອົງປະກອບຂອງມັນ, ດັ່ງນັ້ນມັນບໍ່ແມ່ນ 0, ແຕ່ນັ້ນແມ່ນສິ່ງທີ່ພວກເຮົາຮູ້. ນີ້ແມ່ນຜູ້ສະ ໝັກ ທີ່ດີໃນການສະ ໝັກ ວິທີການນີ້ເພື່ອ ກຳ ນົດຕົວເລກການຜຸພັງຂອງພຶດຊະຄະນິດ.
 ກໍານົດຕົວເລກການຜຸພັງທີ່ຮູ້ຈັກຂອງອົງປະກອບອື່ນໆໃນສານປະສົມ. ການ ນຳ ໃຊ້ກົດລະບຽບການມອບ ໝາຍ ເລກການຜຸພັງ, ພວກເຮົາ ກຳ ນົດຕົວເລກການຜຸພັງໃດທີ່ອະຕອມອື່ນໃນທາດປະສົມມີ. ຈົ່ງຮູ້ເຖິງຂໍ້ຍົກເວັ້ນເຊັ່ນ: O, H, ແລະອື່ນໆ.
ກໍານົດຕົວເລກການຜຸພັງທີ່ຮູ້ຈັກຂອງອົງປະກອບອື່ນໆໃນສານປະສົມ. ການ ນຳ ໃຊ້ກົດລະບຽບການມອບ ໝາຍ ເລກການຜຸພັງ, ພວກເຮົາ ກຳ ນົດຕົວເລກການຜຸພັງໃດທີ່ອະຕອມອື່ນໃນທາດປະສົມມີ. ຈົ່ງຮູ້ເຖິງຂໍ້ຍົກເວັ້ນເຊັ່ນ: O, H, ແລະອື່ນໆ. - ຢູ່ນາ2ສະນັ້ນ4, ພວກເຮົາຮູ້, ໂດຍອີງໃສ່ກົດລະບຽບຂອງພວກເຮົາ, ວ່າ Na ion ມີຄ່າໃຊ້ຈ່າຍ (ແລະດັ່ງນັ້ນຈໍານວນການຜຸພັງ) ຂອງ +1 ແລະວ່າປະລໍາມະນູອົກຊີເຈນມີຕົວເລກການຜຸພັງຂອງ -2.
 ຄູນ ຈຳ ນວນຂອງອະຕອມແຕ່ລະຕົວໂດຍເອົາເລກການຜຸພັງ. ໃນປັດຈຸບັນທີ່ພວກເຮົາຮູ້ຈັກຕົວເລກການຜຸພັງຂອງປະລໍາມະນູທັງຫມົດຍົກເວັ້ນແຕ່ພວກເຮົາບໍ່ຮູ້ຈັກ, ພວກເຮົາຈະຕ້ອງພິຈາລະນາວ່າບາງປະລໍາມະນູເຫຼົ່ານີ້ອາດຈະເກີດຂື້ນຫຼາຍກ່ວາ ໜຶ່ງ ຄັ້ງ. ຄູນແຕ່ລະຕົວຄູນ (ຂຽນເປັນຕົວຫຍໍ້ຫຼັງຈາກສັນຍາລັກຂອງອະຕອມໃນສານປະສົມ) ໂດຍຕົວເລກການຜຸພັງ.
ຄູນ ຈຳ ນວນຂອງອະຕອມແຕ່ລະຕົວໂດຍເອົາເລກການຜຸພັງ. ໃນປັດຈຸບັນທີ່ພວກເຮົາຮູ້ຈັກຕົວເລກການຜຸພັງຂອງປະລໍາມະນູທັງຫມົດຍົກເວັ້ນແຕ່ພວກເຮົາບໍ່ຮູ້ຈັກ, ພວກເຮົາຈະຕ້ອງພິຈາລະນາວ່າບາງປະລໍາມະນູເຫຼົ່ານີ້ອາດຈະເກີດຂື້ນຫຼາຍກ່ວາ ໜຶ່ງ ຄັ້ງ. ຄູນແຕ່ລະຕົວຄູນ (ຂຽນເປັນຕົວຫຍໍ້ຫຼັງຈາກສັນຍາລັກຂອງອະຕອມໃນສານປະສົມ) ໂດຍຕົວເລກການຜຸພັງ. - ໃນຖານະເປັນສໍາລັບ Na2ສະນັ້ນ4, ພວກເຮົາຮູ້ວ່າມີ 2 ປະລໍາມະນູ Na ແລະ 4 ປະລໍາມະນູ O. ຕອນນີ້ພວກເຮົາເຮັດການຄິດໄລ່ດັ່ງຕໍ່ໄປນີ້, 2 × +1, ເພື່ອໃຫ້ໄດ້ຕົວເລກການຜຸພັງຂອງ Na, 2, ແລະພວກເຮົາຄູນ 4 × -2, ຕົວເລກການຜຸພັງຂອງ O, -8.
 ເພີ່ມຜົນໄດ້ຮັບ. ການເພີ່ມຜົນຂອງການຄູນເຫຼົ່ານີ້ໃຫ້ ຈຳ ນວນການຜຸພັງຂອງສານປະສົມ, ໂດຍບໍ່ມີການ ຄຳ ນຶງເຖິງ ຈຳ ນວນການຜຸພັງຂອງອະຕອມທີ່ບໍ່ຮູ້ຈັກ.
ເພີ່ມຜົນໄດ້ຮັບ. ການເພີ່ມຜົນຂອງການຄູນເຫຼົ່ານີ້ໃຫ້ ຈຳ ນວນການຜຸພັງຂອງສານປະສົມ, ໂດຍບໍ່ມີການ ຄຳ ນຶງເຖິງ ຈຳ ນວນການຜຸພັງຂອງອະຕອມທີ່ບໍ່ຮູ້ຈັກ. - ໃນຕົວຢ່າງຂອງພວກເຮົາກັບນາ2ສະນັ້ນ4, ພວກເຮົາເພີ່ມ 2 ເຖິງ -8 ໃຫ້ໄດ້ -6.
 ຄິດໄລ່ຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຕົວໂດຍອີງໃສ່ຄ່າຂອງສານປະສົມ. ດຽວນີ້ທ່ານມີຂໍ້ມູນທັງ ໝົດ ເພື່ອຊອກຫາຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຈັກໂດຍໃຊ້ບາງຄະນິດສາດທີ່ງ່າຍດາຍ. ພວກເຮົາຈະ ນຳ ໃຊ້ສົມຜົນແລະ ຄຳ ຕອບຈາກບາດກ້າວກ່ອນ, ບວກກັບຄ່າ ທຳ ນຽມຂອງສານປະສົມ. ໃນຄໍາສັບຕ່າງໆອື່ນໆ: (ລວມຕົວເລກຂອງການຜຸພັງທີ່ບໍ່ຮູ້ຈັກ) + (ຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຕົວທີ່ທ່ານຕ້ອງການຢາກຮູ້) = (ຮັບຜິດຊອບສານປະສົມ).
ຄິດໄລ່ຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຕົວໂດຍອີງໃສ່ຄ່າຂອງສານປະສົມ. ດຽວນີ້ທ່ານມີຂໍ້ມູນທັງ ໝົດ ເພື່ອຊອກຫາຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຈັກໂດຍໃຊ້ບາງຄະນິດສາດທີ່ງ່າຍດາຍ. ພວກເຮົາຈະ ນຳ ໃຊ້ສົມຜົນແລະ ຄຳ ຕອບຈາກບາດກ້າວກ່ອນ, ບວກກັບຄ່າ ທຳ ນຽມຂອງສານປະສົມ. ໃນຄໍາສັບຕ່າງໆອື່ນໆ: (ລວມຕົວເລກຂອງການຜຸພັງທີ່ບໍ່ຮູ້ຈັກ) + (ຕົວເລກການຜຸພັງທີ່ບໍ່ຮູ້ຕົວທີ່ທ່ານຕ້ອງການຢາກຮູ້) = (ຮັບຜິດຊອບສານປະສົມ).- ໃນຕົວຢ່າງຂອງນາ2ສະນັ້ນ4, ພວກເຮົາແກ້ໄຂບັນຫາດັ່ງຕໍ່ໄປນີ້:
- (ຜົນລວມຂອງຕົວເລກການຜຸພັງທີ່ຮູ້ຈັກ) + (ບໍ່ຮູ້ ຈຳ ນວນການຜຸພັງທີ່ທ່ານຕ້ອງການແກ້ໄຂ) = (ຮັບຜິດຊອບສານປະສົມ)
- -6 + S = 0
- ສ = 0 + 6
- S = 6. S ມີເລກຜຸພັງຫຼື 6 ໃນນາ2ສະນັ້ນ4.
- ໃນຕົວຢ່າງຂອງນາ2ສະນັ້ນ4, ພວກເຮົາແກ້ໄຂບັນຫາດັ່ງຕໍ່ໄປນີ້:
ຄຳ ແນະ ນຳ
- ປະລໍາມະນູໃນຮູບແບບພື້ນຖານຂອງພວກເຂົາສະເຫມີມີຈໍານວນການຜຸພັງຂອງ 0. ion ທີ່ປະກອບດ້ວຍ 1 ປະລໍາມະນູມີຈໍານວນການຜຸພັງເທົ່າກັບຄ່າບໍລິການ. ໂລຫະກຸ່ມ 1A ເຊັ່ນ hydrogen, lithium ແລະ sodium ມີເລກຜຸພັງ +1; ໂລຫະກຸ່ມ 2A, ເຊັ່ນແມກນີຊຽມແລະແຄວຊ້ຽມ, ມີຕົວເລກການຜຸພັງ +2. ທັງ hydrogen ແລະ oxygen ສາມາດມີ 2 ຕົວເລກການຜຸພັງທີ່ແຕກຕ່າງກັນ, ຂື້ນກັບຄວາມຜູກພັນຂອງມັນ.
- ໃນສ່ວນປະສົມລວມຂອງຕົວເລກການຜຸພັງທັງ ໝົດ ຄວນຈະເທົ່າກັບ 0. ຖ້າມີທາດ ion ກັບ 2 ປະລໍາມະນູ, ຫຼັງຈາກນັ້ນຜົນລວມຂອງຕົວເລກການຜຸພັງຄວນຈະເທົ່າກັບການຮັບຜິດຊອບຂອງທາດໄອອອນ.
- ມັນມີປະໂຫຍດຫຼາຍທີ່ຈະຮູ້ວິທີການອ່ານຕາຕະລາງແຕ່ລະໄລຍະແລະບ່ອນທີ່ຈະຊອກຫາໂລຫະແລະໂລຫະທີ່ບໍ່ແມ່ນໂລຫະ.
ຄວາມ ຈຳ ເປັນ
- ຕາຕະລາງແຕ່ລະໄລຍະຂອງອົງປະກອບ
- ການເຊື່ອມຕໍ່ອິນເຕີເນັດ
- ປື້ມເຄມີສາດ
- ເຈ້ຍ, ປາກກາຫລືສໍ
- ເຄື່ອງຄິດໄລ່