ກະວີ:
Lewis Jackson
ວັນທີຂອງການສ້າງ:
8 ເດືອນພຶດສະພາ 2021
ວັນທີປັບປຸງ:
23 ມິຖຸນາ 2024
ເນື້ອຫາ
ສົມຜົນທາດ ionic ແມ່ນສ່ວນ ໜຶ່ງ ທີ່ ສຳ ຄັນຂອງເຄມີສາດເພາະມັນເປັນຕົວແທນຂອງອະນຸພາກທີ່ປ່ຽນແປງໃນປະຕິກິລິຍາເຄມີ. ພວກມັນຖືກນໍາໃຊ້ຫຼາຍທີ່ສຸດໃນປະຕິກິລິຍາຫຼຸດຜ່ອນການຜຸພັງ, ປະຕິກິລິຍາກ່ຽວກັບທາດແປ້ງ, ແລະປະຕິກິລິຍາທີ່ເປັນກາງຂອງອາຊິດ - ຖານ. ມີສາມຂັ້ນຕອນຂັ້ນພື້ນຖານໃນການຂຽນສົມຜົນໄຮໂດລິກ: ສົມຜົນສົມຜົນໂມເລກຸນ, ປ່ຽນມັນໃຫ້ສົມຜົນກັບທາດສົມຜົນ ionic ເຕັມ (ວິທີການແຕ່ລະສານມີຢູ່ໃນການແກ້ໄຂ), ແລະສຸດທ້າຍຂຽນສົມຜົນ ionic ສົມຜົນ.
ຂັ້ນຕອນ
ສ່ວນທີ 1 ຂອງ 2: ເຂົ້າໃຈສ່ວນປະກອບຂອງສົມຜົນທາດອິໂມໂນ
ຮູ້ຄວາມແຕກຕ່າງລະຫວ່າງໂມເລກຸນແລະ ທາດປະສົມທາດອາຊິໂນ. ຂັ້ນຕອນ ທຳ ອິດໃນການຂຽນສົມຜົນ ionic ສຸດທິແມ່ນການ ກຳ ນົດທາດທາດ ionic ໃນປະຕິກິລິຍາ. ທາດໄອໂອດີນແມ່ນທາດທີ່ແຍກທາດ Iions ໃນທາງແກ້ທີ່ມີນ້ ຳ ໜັກ ແລະມີຄ່າໄຟຟ້າ. ທາດປະສົມໂມເລກຸນແມ່ນທາດປະສົມທີ່ບໍ່ເຄີຍຄິດຄ່າໄຟຟ້າ. ພວກມັນຖືກສ້າງຕັ້ງຂື້ນລະຫວ່າງສອງ nonmetals ແລະບາງຄັ້ງກໍ່ຖືກເອີ້ນວ່າທາດປະສົມ.
- ທາດປະສົມ Ionic ສາມາດຖືກສ້າງຕັ້ງຂື້ນລະຫວ່າງໂລຫະແລະ nonmetals, ໂລຫະແລະ ions polyatomic, ຫຼື ions polyatomic ຫຼາຍ.
- ຖ້າທ່ານບໍ່ແນ່ໃຈວ່າທາດປະສົມແມ່ນຫຍັງ, ທ່ານສາມາດຊອກຫາອົງປະກອບຕ່າງໆທີ່ຢູ່ໃນປະສົມນັ້ນຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ.

ຮັບຮູ້ເຖິງການລະລາຍຂອງສານປະສົມ. ບໍ່ແມ່ນທາດປະສົມທາດ ionic ທັງ ໝົດ ທີ່ລະລາຍໃນທາດເຫລັກ, ແລະເພາະສະນັ້ນຈຶ່ງບໍ່ສາມາດແຍກທາດໄອອອນໄດ້. ທ່ານຕ້ອງລະບຸການລະລາຍຂອງແຕ່ລະທາດປະສົມກ່ອນທີ່ຈະ ດຳ ເນີນສົມຜົນກັບສ່ວນທີ່ເຫຼືອຂອງສົມຜົນ. ຂ້າງລຸ່ມນີ້ແມ່ນບົດສະຫຼຸບຂອງກົດລະບຽບການລະລາຍ. ຊອກຫາຕາຕະລາງການລະລາຍ ສຳ ລັບຂໍ້ມູນລະອຽດແລະຂໍ້ຍົກເວັ້ນຕໍ່ກົດລະບຽບເຫຼົ່ານີ້.- ປະຕິບັດຕາມກົດລະບຽບເຫຼົ່ານີ້ໃນຄໍາສັ່ງທີ່ລະບຸໄວ້ຂ້າງລຸ່ມນີ້:
- ເກືອທັງ ໝົດ Na, K, ແລະ NH4 ທັງ ໝົດ ລະລາຍ.
- ເກືອທັງ ໝົດ3, ຄ2ຮ3ອ2, ClO3, ແລະ ClO4 ທັງຫມົດລະລາຍ.
- ເກືອ Ag, Pb, ແລະ Hg ທັງ ໝົດ2 ທັງຫມົດລະລາຍ.
- ເກືອ Cl, Br, ແລະເກືອທັງ ໝົດ ແມ່ນລະລາຍ.
- ທຸກໆເກືອ CO3, O, S, OH, PO4, CrO4, ທ2ອ7, ແລະ SO3 ຖືກລະລາຍ (ຍົກເວັ້ນໃນບາງກໍລະນີ).
- ເກືອ SO ທັງ ໝົດ4 ລະລາຍທັງ ໝົດ (ຍົກເວັ້ນໃນບາງກໍລະນີ).
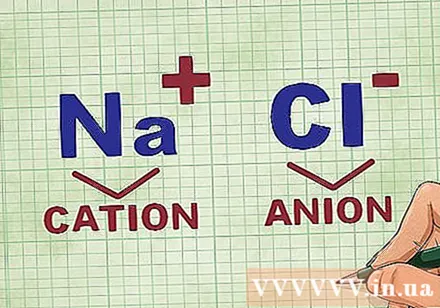
ການ ກຳ ນົດ cations ແລະ anions ໃນສານປະສົມ. Cations ແມ່ນ ions ບວກໃນທາດປະສົມແລະປົກກະຕິແມ່ນໂລຫະ. The anion ແມ່ນທາດໄອອອນທາງລົບໃນທາດປະສົມແລະບໍ່ແມ່ນໂລຫະ. ບາງ nonmetals ສາມາດປະກອບ cations, ແຕ່ໂລຫະສະເຫມີປະກອບ cations.- ຍົກຕົວຢ່າງ, ໃນ NaCl, Na ແມ່ນສານອ້າງອີງໃນທາງບວກເນື່ອງຈາກວ່າມັນເປັນໂລຫະ, ແລະ Cl ແມ່ນ anion ຄິດຄ່າລົບໃນທາງລົບເພາະວ່າມັນບໍ່ແມ່ນຕົວຕົນ.

ຮັບຮູ້ເຖິງທາດໄອໂອໂຕໂມຕິກໃນປະຕິກິລິຍາ. ແຮ່ທາດໂພລີເມຕິກແມ່ນຄິດໄລ່ໂມເລກຸນທີ່ຖືກຜູກມັດກັນແລະກັນແລະບໍ່ແຍກໃນລະຫວ່າງການມີປະຕິກິລິຍາທາງເຄມີ. ມັນເປັນສິ່ງສໍາຄັນທີ່ຈະຮັບຮູ້ເຖິງທາດໄອໂອໂຕແບບໂພລີໂມນເພາະວ່າພວກມັນມີຄ່າໃຊ້ຈ່າຍສະເພາະແລະບໍ່ແຍກ. ions Polyatomic ສາມາດມີຄ່າໃຊ້ຈ່າຍໃນທາງບວກຫຼືລົບ.- ຖ້າທ່ານ ກຳ ລັງຮຽນວິຊາເຄມີທົ່ວໄປ, ມັນມັກຈະ ຈຳ ເປັນຕ້ອງຈື່ ຈຳ ໄວ້ວ່າທາດໄອອອນໂພຊີຕິກທົ່ວໄປ.
- ບາງສ່ວນຂອງທາດເຫຼັກ polyatomic ທົ່ວໄປແມ່ນ CO3, ບໍ່3, ບໍ່2, ສະນັ້ນ4, ສະນັ້ນ3, ClO4 ແລະ ClO3.
- ທ່ານຍັງສາມາດຊອກຫາໄອອອນອື່ນໆອີກຫລາຍໆຢ່າງໃນປື້ມເຄມີສາດຫລືໃນອິນເຕີເນັດ.
ພາກທີ 2 ຂອງ 2: ການຂຽນສົມຜົນໄອອອນສຸດທິ
ສົມຜົນສົມຜົນໂມເລກຸນ. ກ່ອນທີ່ຈະຂຽນສົມຜົນ ionic ສົມຜົນ, ທ່ານຕ້ອງຮັບປະກັນວ່າສົມຜົນໂມເລກຸນຂອງທ່ານມີຄວາມສົມດຸນ. ເພື່ອໃຫ້ສົມຜົນສົມຜົນ, ທ່ານເພີ່ມຕົວຄູນຢູ່ທາງ ໜ້າ ຂອງສານປະສົມເພື່ອໃຫ້ ຈຳ ນວນປະລໍາມະນູຂອງແຕ່ລະອົງປະກອບເທົ່າກັບທັງສອງດ້ານຂອງສົມຜົນ.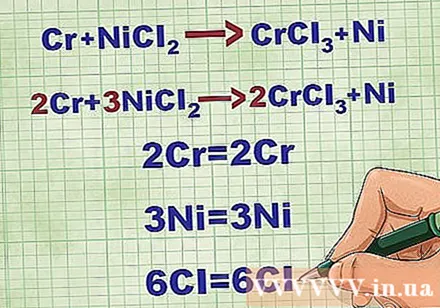
- ຂຽນ ຈຳ ນວນອະຕອມທີ່ເຮັດໃຫ້ແຕ່ລະສ່ວນປະສົມຢູ່ທັງສອງດ້ານຂອງສົມຜົນ.
- ຕື່ມຕົວຄູນຢູ່ທາງ ໜ້າ ຂອງອົງປະກອບຕ່າງໆນອກ ເໜືອ ຈາກອົກຊີເຈນແລະໄຮໂດເຈນເພື່ອດຸ່ນດ່ຽງກັນ.
- ຄວາມສົມດຸນຂອງອະຕອມໄຮໂດເຈນ.
- ຍອດປະລໍາມະນູອົກຊີເຈນ.
- ນັບ ຈຳ ນວນອະຕອມໃນແຕ່ລະຂ້າງຂອງສົມຜົນເພື່ອໃຫ້ແນ່ໃຈວ່າມັນມີຄວາມສົມດຸນ.
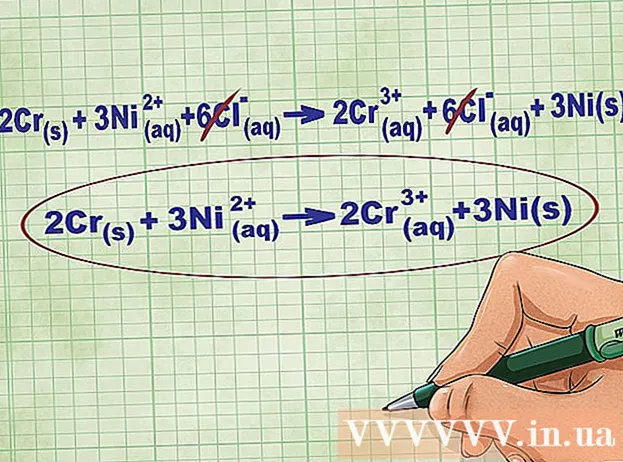
- ຍົກຕົວຢ່າງ, Cr + NiCl2 -> CrCl3 + ນ ດຸ່ນດ່ຽງກັບ 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
ລະບຸສະພາບຂອງທາດປະສົມໃນສົມຜົນ. ຫຼາຍຄັ້ງໃນບັນຫາມີ ຄຳ ສຳ ຄັນທີ່ຈະແຈ້ງໃຫ້ທ່ານຮູ້ສະພາບການຂອງແຕ່ລະປະສົມ. ມີກົດລະບຽບຫຼາຍຢ່າງທີ່ຊ່ວຍໃນການ ກຳ ນົດສະພາບຂອງທາດຫຼືທາດປະສົມ.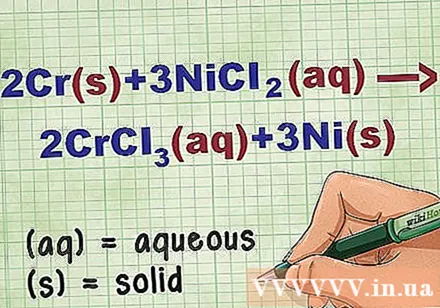
- ຖ້າບໍ່ມີລັດໃດ ສຳ ລັບອົງປະກອບ, ໃຫ້ໃຊ້ລັດທີ່ພົບໃນຕາຕະລາງແຕ່ລະໄລຍະ.
- ຖ້າສານປະສົມຖືກເອີ້ນວ່າວິທີແກ້ໄຂ, ທ່ານສາມາດຂຽນມັນເປັນນ້ ຳ ເມືອກຫລື (ງ).
- ຖ້າມີນ້ ຳ ຢູ່ໃນສະມະການ, ທ່ານຕ້ອງ ກຳ ນົດວ່າທາດປະສົມທາດ ionic ແມ່ນລະລາຍໃນນ້ ຳ ໄດ້ໂດຍການ ນຳ ໃຊ້ຕາຕະລາງການລະລາຍ. ຖ້າການລະລາຍສູງ, ທາດປະສົມຈະມີນ້ ຳ ລາຍ (ງ), ຖ້າການລະລາຍຕໍ່າ, ສານປະສົມຈະແຂງ (ລ).
- ຖ້າບໍ່ມີນ້ ຳ, ສານປະສົມ ionic ແມ່ນແຂງ (ລ).
- ຖ້າບັນຫາມັນເປັນກົດຫລືພື້ນຖານ, ຫຼັງຈາກນັ້ນສານປະສົມແມ່ນມີນ້ ຳ ລາຍ (ງ).
- ຕົວຢ່າງ, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. ຮູບແບບອົງປະກອບຂອງ Cr ແລະ Ni ແມ່ນຢູ່ໃນສະພາບທີ່ແຂງແກ່ນ. NiCl2 ແລະ CrCl3 ທາດປະສົມທາດ ionic ແມ່ນລະລາຍ, ສະນັ້ນພວກມັນມີນ້ ຳ ແຂງ. ຂຽນ ໃໝ່ ສົມຜົນເປັນ: 2 ຄ(ລ) + 3NiCl2(ງ) -> 2CrCl3(ງ) + 3Ni(ລ).
ກຳ ນົດສານປະສົມໃດທີ່ຈະແຍກ (ແຍກອອກເປັນ cations ແລະ anions) ໃນການແກ້ໄຂ. ເມື່ອສານຫຼືສານປະສົມລົບກວນ, ມັນຈະແຍກທາດ ion (cation) ແລະໄອອອນ (ຄິດໄລ່) ໃນແງ່ລົບ. ເຫຼົ່ານີ້ແມ່ນສ່ວນປະກອບທີ່ຈະສົມດູນໃນຕອນທ້າຍຂອງສົມຜົນ ionic ສຸດທິ.
- ທາດລະລາຍ, ທາດແຫຼວ, ທາດອາຍຜິດ, ທາດໂມເລກຸນ, ທາດປະສົມທາດ ionic ລະລາຍຕ່ ຳ, ທາດໄອເທັກ polyatomic ແລະອາຊິດອ່ອນແອຈະບໍ່ແຕກແຍກ.
- ທາດປະສົມ Ionic ມີສານລະລາຍສູງ (ໃຊ້ຕາຕະລາງການລະລາຍ) ແລະກົດທີ່ແຂງແຮງຈະ ionize 100% (HCl(ງ), ທ(ງ), HI(ງ), ຮ2ສະນັ້ນ4(ງ), HClO4(ງ), ແລະ HNO3(ງ)).
- ໝາຍ ເຫດ, ເຖິງແມ່ນວ່າທາດໄອເທັກໂພລິເມີບໍ່ແຕກແຍກອີກຕໍ່ໄປ, ຖ້າພວກມັນມີສ່ວນປະກອບຂອງທາດປະສົມນັ້ນ, ພວກມັນຈະແຍກອອກຈາກທາດປະສົມ.
ຄິດໄລ່ຄ່າບໍລິການຂອງແຕ່ລະທາດ ion ທີ່ແຍກອອກຈາກທາດປະສົມ. ຈົ່ງຈື່ໄວ້ວ່າໂລຫະຈະປະກອບເປັນ ions ບວກແລະ nonmetals ຈະປະກອບເປັນ ions ລົບ. ໃຊ້ຕາຕະລາງແຕ່ລະໄລຍະເພື່ອ ກຳ ນົດຄ່າຂອງອົງປະກອບ. ທ່ານຍັງຕ້ອງໄດ້ດຸ່ນດ່ຽງການຮັບຜິດຊອບຂອງແຕ່ລະທາດໃນທາດປະສົມ.
- ໃນຕົວຢ່າງນີ້, NiCl2 ແຍກອອກເປັນ Ni ແລະ Cl ໃນຂະນະທີ່ CrCl3 ແບ່ງອອກເປັນ Cr ແລະ Cl.
- Ni ມີຄ່າໃຊ້ຈ່າຍ 2+ ເພາະວ່າ Cl ມີຄ່າໃຊ້ຈ່າຍໃນແງ່ລົບແຕ່ມີ 2 ປະລໍາມະນູ. ສະນັ້ນ, ພວກເຮົາຕ້ອງໄດ້ດຸ່ນດ່ຽງກັບ 2 Cl Clions ລົບ. Cr ມີຄ່າໃຊ້ຈ່າຍ 3+, ດັ່ງນັ້ນພວກເຮົາຕ້ອງດຸ່ນດ່ຽງກັບ 3 Cl Clions ລົບ.
- ຈື່ໄວ້ວ່າ ions polyatomic ມີຄ່າໃຊ້ຈ່າຍສະເພາະ.
ຂຽນສົມຜົນທາດອິໂມນິກສົມບູນ. ສິ່ງໃດກໍ່ຕາມທີ່ແບ່ງແຍກຫລືທາດ ionizes (ທາດອາຊິດເຂັ້ມແຂງ) ແຍກອອກເປັນສອງໄອອອນແຍກຕ່າງຫາກ. ສະພາບຂອງສານງ), ແຕ່ໃຫ້ແນ່ໃຈວ່າສົມຜົນຍັງມີຄວາມສົມດຸນ.
- ທາດລະລາຍ, ທາດແຫຼວ, ທາດອາຍຜິດ, ອາຊິດອ່ອນແອ, ແລະທາດປະສົມທາດໄອໂອຣີນລະລາຍຕໍ່າບໍ່ປ່ຽນສະຖານະຫລືແຍກອອກເປັນໄອອອນ. ພວກເຮົາຮັກສາພວກມັນໄວ້.
- ສານໂມເລກຸນຈະກະແຈກກະຈາຍໃນການແກ້ໄຂເພື່ອໃຫ້ສະພາບການຂອງມັນປ່ຽນໄປ (ງ). ສາມຂໍ້ຍົກເວັ້ນ ບໍ່ແມ່ນ ກາຍເປັນ (ງ) ແມ່ນ: ສ4(ກ), ຄ3ຮ8(ກ), ແລະຄ8ຮ18(ທ).
- ສືບຕໍ່ໄປດ້ວຍຕົວຢ່າງຂ້າງເທິງ, ສົມຜົນທາດ ionic ເຕັມຮູບແບບນີ້: 2Cr(ລ) + 3Ni(ງ) + 6 ຄ(ງ) -> 2 ຄ(ງ) + 6 ຄ(ງ) + 3Ni(ລ). ເມື່ອ Cl ບໍ່ຢູ່ໃນທາດປະສົມ, ມັນບໍ່ແມ່ນ bipolar, ດັ່ງນັ້ນພວກເຮົາຈຶ່ງຄູນປັດໄຈດ້ວຍ ຈຳ ນວນຂອງອະຕອມໃນທາດປະສົມເພື່ອໃຫ້ໄດ້ 6 Cl ions ໃນສອງດ້ານຂອງສົມຜົນ.
ດຶງອອກຈາກທາດໄອເທັນທີ່ສົມດຸນໂດຍຍົກເລີກການອອກ ions ດຽວກັນໃນແຕ່ລະດ້ານຂອງສົມຜົນ. ທ່ານສາມາດຍົກເລີກໄດ້ຖ້າພວກມັນມີຄວາມຄືກັນທັງສອງດ້ານ (ຄ່າບໍລິການ, ຈຳ ນວນປະລໍາມະນູ, ແລະອື່ນໆ). ຂຽນ ໃໝ່ ສົມຜົນໂດຍບໍ່ມີສານທີ່ ທຳ ລາຍ.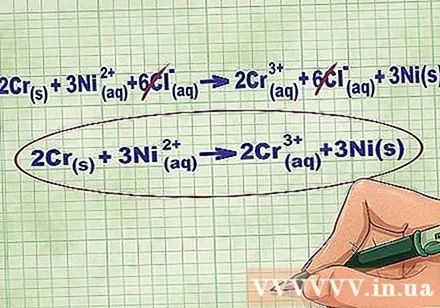
- ຫລັງຈາກເຮັດ ສຳ ເລັດຕົວຢ່າງ, ພວກເຮົາມີ ions Cl equilibrium ທີ່ຍົກເລີກໄດ້ໃນແຕ່ລະດ້ານ. ສົມຜົນ ionic ສຸດທິແມ່ນ 2Cr(ລ) + 3Ni(ງ) -> 2 ຄ(ງ) + 3Ni(ລ).
- ຖ້າທ່ານຖືກຕ້ອງແລ້ວຄ່າບໍລິການທັງ ໝົດ ທີ່ຢູ່ໃນເຕົາປະຕິກອນຄວນຈະເທົ່າກັບຄ່າບໍລິການທັງ ໝົດ ທີ່ຢູ່ໃນຜະລິດຕະພັນໃນສະມະການ ionic ສົມຜົນ.
ຄຳ ແນະ ນຳ
- ຂຽນສະຖານະຂອງສານທັງ ໝົດ ໃນສົມຜົນ, ຖ້າບໍ່ແມ່ນທ່ານ ຈະ ສູນເສຍຈຸດ.