ກະວີ:
Lewis Jackson
ວັນທີຂອງການສ້າງ:
6 ເດືອນພຶດສະພາ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
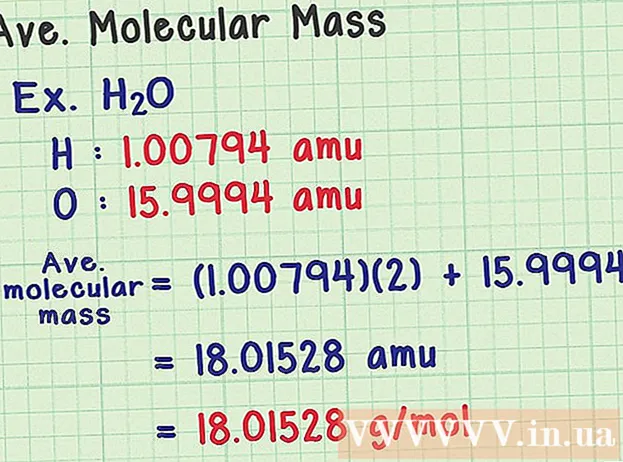
ເນື້ອຫາ
ປະລິມານມະຫາຊົນສະເລ່ຍບໍ່ແມ່ນການວັດແທກໂດຍກົງຂອງມວນຂອງອະຕອມ. ແທນທີ່ຈະ, ນີ້ແມ່ນມວນສານສະເລ່ຍຕໍ່ອາຕອມຈາກຕົວຢ່າງປົກກະຕິຂອງອົງປະກອບ. ຖ້າທ່ານສາມາດວັດປະລິມານຫລາຍພັນຕື້ຂອງປະລໍາມະນູສ່ວນບຸກຄົນ, ທ່ານສາມາດຊອກຫາສິ່ງນີ້ໄດ້ໂດຍການຄິດໄລ່ສະເລ່ຍຂອງພວກມັນ. ພວກເຮົາມີວິທີການປະຕິບັດຕົວຈິງຫຼາຍຂື້ນ, ເຊິ່ງອີງໃສ່ຂໍ້ມູນກ່ຽວກັບໄອໂຊໂທບທີ່ແຕກຕ່າງກັນຂອງອົງປະກອບເຄມີ.
ຂັ້ນຕອນ
ສ່ວນທີ 1 ຂອງ 2: ຄິດໄລ່ປະລິມານມະຫາຊົນສະເລ່ຍ
ເຂົ້າໃຈໄອໂຊໂທບແລະອະຕອມຂອງມະຫາຊົນ. ໃນ ທຳ ມະຊາດ, ອົງປະກອບສ່ວນໃຫຍ່ມີຫລາຍຮູບແບບຫລື isotopes. ຄວາມແຕກຕ່າງພຽງແຕ່ລະຫວ່າງສອງ isotopes ຂອງອົງປະກອບດຽວກັນແມ່ນ ຈຳ ນວນນິວເຄຼຍໃນອະຕອມເຊິ່ງ ຈຳ ນວນນິວເຄຼຍມີຜົນກະທົບຕໍ່ອະຕອມຂອງມວນ. ການຄິດໄລ່ປະລິມານມະຫາຊົນສະເລ່ຍຄິດໄລ່ເຖິງຜົນກະທົບຂອງຄວາມແຕກຕ່າງນີ້, ແລະບອກປະລິມານສະເລ່ຍຂອງແຕ່ລະປະລໍາມະນູໃນຕົວຢ່າງຂອງປະລໍາມະນູເຫລົ່ານັ້ນ.
- ຕົວຢ່າງ, ເງິນອົງປະກອບ (Ag) ມີສອງ isotopes ທໍາມະຊາດ: Ag-107 ແລະ Ag-109 (ຫຼື Ag ແລະ Ag). ໄອໂຊໂທບແມ່ນຕັ້ງຊື່ຕາມ "ຈຳ ນວນມະຫາຊົນ", ຫລືຜົນລວມຂອງ ຈຳ ນວນໂປໂຕຄອນແລະ ຈຳ ນວນນິວເຄຼຍໃນອະຕອມ. ນັ້ນ ໝາຍ ຄວາມວ່າ Ag-109 ມີນິວເຄຼຍອີກສອງເທົ່າກ່ວາ Ag-107, ສະນັ້ນອະຕອມຂອງມັນ ໜັກ ກວ່າເລັກນ້ອຍ.

ຊອກຫາມວນສານຂອງແຕ່ລະ isotope. ທ່ານຕ້ອງການສອງສ່ວນຂອງຂໍ້ມູນ ສຳ ລັບແຕ່ລະ isotope, ທ່ານສາມາດຊອກຫາຂໍ້ມູນເຫລົ່ານັ້ນຢູ່ໃນປື້ມອ້າງອີງຫລືຊອກຫາທາງອິນເຕີເນັດ, ຍົກຕົວຢ່າງ webelements.com. ທຳ ອິດແມ່ນທາດອະຕອມຫຼືອະຕອມຂອງແຕ່ລະທາດ isotope. Isotopes ທີ່ມີ neutron ມີມວນສານຫຼາຍຂື້ນ.- ຍົກຕົວຢ່າງ, ເງິນ isotope Ag-107 ມີອະຕອມມະຫາຊົນ 106.90509 amu (ຫົວ ໜ່ວຍ ຂອງປະລໍາມະນູກ້ອນ.) Isotope Ag-109 ມີນ້ ຳ ໜັກ ໜັກ ກ່ວາມະຫາຊົນ 108,90470.
- ຄູ່ຂອງອັດຕານິຍົມໃນຕອນທ້າຍສາມາດແຕກຕ່າງກັນເລັກນ້ອຍໃນເອກະສານ. ຢ່າຂຽນຕົວເລກໃດໆໃນວົງເລັບຫຼັງຈາກມະຫາຊົນ.

ໃຫ້ຂຽນອັດຕາການລອດຊີວິດແບບ ທຳ ມະຊາດ ສຳ ລັບແຕ່ລະ isotope. ອັດຕາສ່ວນນີ້ບົ່ງບອກເຖິງຄວາມເປັນສ່ວນຕົວຂອງ isotope, ເຊິ່ງເປັນເປີເຊັນຂອງອະຕອມທັງ ໝົດ ຂອງອົງປະກອບ. ທ່ານສາມາດຊອກຫາຂໍ້ມູນນີ້ໃນເອກະສານດຽວກັນກັບປະລໍາມະນູກ້ອນໃນມັນ. ການຢູ່ລອດແບບ ທຳ ມະຊາດຂອງໄອໂຊໂທບທັງ ໝົດ ຄວນຈະເປັນ 100% (ເຖິງແມ່ນວ່າມັນອາດຈະແຕກຕ່າງກັນເລັກນ້ອຍຍ້ອນຄວາມຜິດພາດຂອງການຮອບວຽນ).- isotope Ag-107 ມີອັດຕາສ່ວນ 51,86%. isotope Ag-109 ແມ່ນພົບ ໜ້ອຍ ໃນອັດຕາ 48,14%. ນັ້ນ ໝາຍ ຄວາມວ່າຕົວຢ່າງເງິນ ທຳ ມະດາມີ 51,86% Ag-107 ແລະ 48.14% Ag-109.
- isotopes ໃດທີ່ບໍ່ມີອັດຕາການຢູ່ລອດນີ້ຈະຖືກລະເລີຍ. ໄອໂຊໂທບເຫລົ່ານີ້ບໍ່ມີຢູ່ໃນໂລກ.

ປ່ຽນອັດຕາສ່ວນ isotope ເປັນເລກທົດສະນິຍົມ. ແບ່ງອັດຕາສ່ວນນີ້ໃຫ້ 100 ຈະໃຫ້ມູນຄ່າເທົ່າກັບທົດສະນິຍົມ.- ໃນຕົວຢ່າງເງິນຂ້າງເທິງ, ອັດຕາສ່ວນຂອງ isotopes ແມ່ນ 51.86 / 100 = 0,5186 ແລະ 48,14 / 100 = 0,4814.
ຊອກຫາປະລໍາມະນູກ້ອນໂດຍສະເລ່ຍ. ປະລິມານມະຫາສານສະເລ່ຍຂອງອົງປະກອບ ໜຶ່ງ ມີ ນ isotopes ເທົ່າກັນ (ຕັນປະລໍາມະນູIsotope 1 * ອັດຕາສ່ວນIsotope 1) + (ມະຫາຊົນປະລໍາມະນູIsotope 2 * ອັດຕາສ່ວນIsotope 2) + ... + (ປະລໍາມະນູກ້ອນisotopes ນ * ອັດຕາສ່ວນisotopes ນ. ນີ້ແມ່ນຕົວຢ່າງຂອງ "ມວນສານສະເລ່ຍ", ໝາຍ ຄວາມວ່າອັດຕາການລອດຊີວິດຂອງໄອໂຊໂທນຫຼາຍຂື້ນ, ມັນຈະມີຜົນກະທົບຕໍ່ຜົນໄດ້ຮັບຫຼາຍກວ່າເກົ່າ. ວິທີການ ນຳ ໃຊ້ສູດນີ້ ສຳ ລັບເງິນມີດັ່ງນີ້:
- ປະລິມານມະຫາຊົນຂະ ໜາດ ກາງAg = (ປະລໍາມະນູກ້ອນAg-107 * ອັດຕາສ່ວນAg-107) + (ມະຫາຊົນປະລໍາມະນູAg-109 * ອັດຕາສ່ວນAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107.8677 amu. - ຊອກຫາອົງປະກອບນັ້ນໃນຕາຕະລາງແຕ່ລະໄລຍະເພື່ອກວດກາຜົນໄດ້ຮັບ. ປະລໍາມະນູກ້ອນໂດຍສະເລ່ຍແມ່ນຂຽນຢູ່ລຸ່ມສັນຍາລັກທາງເຄມີຂອງອົງປະກອບ.
- ປະລິມານມະຫາຊົນຂະ ໜາດ ກາງAg = (ປະລໍາມະນູກ້ອນAg-107 * ອັດຕາສ່ວນAg-107) + (ມະຫາຊົນປະລໍາມະນູAg-109 * ອັດຕາສ່ວນAg-109)
ສ່ວນທີ 2 ຂອງ 2: ການ ນຳ ໃຊ້ຜົນໄດ້ຮັບ
ປ່ຽນມວນສານເປັນເລກປະລໍາມະນູ. ອະຕອມຂອງມະຫາສະເລ່ຍສະແດງໃຫ້ເຫັນຄວາມ ສຳ ພັນລະຫວ່າງມວນແລະ ຈຳ ນວນຂອງອະຕອມໃນຕົວຢ່າງປົກກະຕິຂອງອົງປະກອບນັ້ນ. ນີ້ມີປະໂຫຍດຫຼາຍໃນຫ້ອງທົດລອງທາງເຄມີເພາະມັນເກືອບຈະເປັນໄປບໍ່ໄດ້ທີ່ຈະນັບປະລໍາມະນູໄດ້ຢ່າງຖືກຕ້ອງ, ແຕ່ວ່າມະຫາຊົນແມ່ນງ່າຍທີ່ຈະ ກຳ ນົດໄດ້. ຍົກຕົວຢ່າງ, ທ່ານສາມາດຊັ່ງນໍ້າ ໜັກ ຂອງຕົວຢ່າງເງິນແລະຮູ້ວ່າມັນຈະມີປະລໍາມະນູເງິນ ໜຶ່ງ ໜ່ວຍ ສຳ ລັບທຸກໆ 107.8677 amu.
ປ່ຽນເປັນມະຫາຊົນ molar. ຫນ່ວຍບໍລິການມະຫາຊົນປະລໍາມະນູແມ່ນມີຂະຫນາດນ້ອຍຫຼາຍ, ສະນັ້ນນັກເຄມີສາດມັກຈະໃຊ້ຫົວ ໜ່ວຍ ປະລິມານກຼາມ ສຳ ລັບມະຫາຊົນ. ໂຊກດີທີ່ພວກເຮົາມີ ຄຳ ນິຍາມຂອງແນວຄິດເຫຼົ່ານີ້ສະນັ້ນການຫັນປ່ຽນຄວນເປັນເລື່ອງງ່າຍ. ພຽງແຕ່ຄູນອັດຕາສ່ວນປະລິມານສະເລ່ຍໂດຍ 1 g / mol (ມະຫາຊົນ molar ຄົງທີ່) ເພື່ອໃຫ້ໄດ້ຜົນໃນ g / mol. ຍົກຕົວຢ່າງ, ເງິນ 107,8677 ກຼາມບັນຈຸມີທາດໂມເລກຸນ ໜຶ່ງ ກ້ອນ.
ຊອກຫາໂມເລກຸນໂມເລກຸນສະເລ່ຍ. ເນື່ອງຈາກໂມເລກຸນແມ່ນການລວບລວມຂອງອະຕອມ, ທ່ານສາມາດເພີ່ມປະລິມານຂອງອະຕອມທັງ ໝົດ ເພື່ອຊອກຫາມະຫາຊົນໂມເລກຸນ. ຖ້າທ່ານໃຊ້ອະຕອມຂອງໂມເລກຸນໂດຍສະເລ່ຍ (ແທນທີ່ຈະເປັນມວນຂອງ isotope ໂດຍສະເພາະ), ຜົນໄດ້ຮັບຈະເປັນໂມເລກຸນສະເລ່ຍຂອງຕົວຢ່າງໃນ ທຳ ມະຊາດ. ນີ້ແມ່ນຕົວຢ່າງ:
- ໂມເລກຸນນ້ ຳ ມີສູດເຄມີ H2O ປະກອບມີສອງປະລໍາມະນູໄຮໂດເຈນ (H) ແລະປະລໍາມະນູອົກຊີເຈນ (O).
- ໄຮໂດເຈນມີປະລິມານມວນສານສະເລ່ຍຂອງ 1,00794 amu. ອົກຊີເຈນມີມະຫາຊົນປະລໍາມະນູສະເລ່ຍຂອງ 15,9994 amu.
- ສະນັ້ນໂມເລກຸນໂມເລກຸນສະເລ່ຍຂອງ H2O ເທົ່າກັບ (1,00794) (2) + 15,9994 = 18,01528 amu, ເຊິ່ງເທົ່າກັບ 18.01528 g / mol.
ຄຳ ແນະ ນຳ
- ແນວຄວາມຄິດຂອງມວນສານປະລໍາມະນູທີ່ມີຄວາມກ່ຽວຂ້ອງບາງຄັ້ງກໍ່ຖືກນໍາໃຊ້ຄໍາສັບຄ້າຍຄືກັບປະລໍາມະນູຂອງມວນສານສະເລ່ຍ. ມີຄວາມແຕກຕ່າງເລັກນ້ອຍເພາະວ່າທາດປະລໍາມະນູແມ່ນຂ້ອນຂ້າງເປັນຫນ່ວຍ; ມັນແມ່ນການວັດແທກຂອງມວນສານທີ່ກ່ຽວຂ້ອງກັບປະລໍາມະນູຄາບອນ -12. ຕາບໃດທີ່ທ່ານໃຊ້ຫົວ ໜ່ວຍ ມະຫາຊົນປະລໍາມະນູໃນການຄິດໄລ່ປະລໍາມະນູກ້ອນໂດຍສະເລ່ຍແລ້ວ, ຄ່າສອງຢ່າງນີ້ແມ່ນຄືກັນ.
- ຕົວເລກໃນວົງເລັບຫຼັງຈາກປະລໍາມະນູລູກບາດບອກພວກເຮົາຂໍ້ຜິດພາດ. ຕົວຢ່າງ: ອະຕອມຂອງມະຫາຊົນ 1.0173 (4) ໝາຍ ຄວາມວ່າອະຕອມ ທຳ ມະດາຂອງອົງປະກອບມີລະດັບມະຫາຊົນປະມານ 1.0173 ± 0.0004. ທ່ານບໍ່ ຈຳ ເປັນຕ້ອງໄດ້ເອົາເລກນີ້ຖ້າມັນບໍ່ຖືກຮຽກຮ້ອງ.
- ໃນຕາຕະລາງແຕ່ລະໄລຍະ, ປະລໍາມະນູກ້ອນສະເລ່ຍຂອງອົງປະກອບຕໍ່ໄປນີ້ຈະໃຫຍ່ກວ່າໂຕເຄື່ອງກ່ອນມັນ, ມີຂໍ້ຍົກເວັ້ນບໍ່ຫຼາຍປານໃດ. ນີ້ແມ່ນວິທີທີ່ໄວເພື່ອກວດກາຜົນຂອງທ່ານ.
- 1 ໜ່ວຍ ມະຫາຊົນປະລໍາມະນູແມ່ນ 1/12 ມະຫາຊົນຂອງປະລໍາມະນູຄາບອນ -12.
- ອັດຕາການລອດຊີວິດຂອງ Isotope ຖືກຄິດໄລ່ຕາມຕົວຢ່າງທີ່ເກີດຂື້ນຕາມ ທຳ ມະຊາດໃນໂລກ. ສານທີ່ບໍ່ເກີດຂື້ນຕາມ ທຳ ມະຊາດເຊັ່ນ: ອຸຕຸນິຍົມຫລືສິ່ງ ໜຶ່ງ ທີ່ຜະລິດໃນຫ້ອງທົດລອງສາມາດມີອັດຕາສ່ວນ isotope ແຕກຕ່າງກັນ, ສະນັ້ນ, ປະລິມານມະຫາຊົນສະເລ່ຍກໍ່ແຕກຕ່າງກັນ.
ຄຳ ເຕືອນ
- ປະລໍາມະນູມະຫາຊົນຖືກຂຽນເປັນສ່ວນປະກອບຂອງມະຫາຊົນປະລໍາມະນູ (amu ຫຼື u), ບາງຄັ້ງກໍ່ເອີ້ນວ່າ daltons (Da). ບໍ່ເຄີຍຂຽນມວນມະຫາຊົນອີກ ໜ່ວຍ ໜຶ່ງ (ເຊັ່ນ: ກິໂລກຼາມ) ຫຼັງຈາກເລກນີ້ໂດຍບໍ່ຕ້ອງປ່ຽນມັນ.
ເຈົ້າຕ້ອງການຫັຍງ
- ດິນສໍ
- ເຈ້ຍ
- ແລັບທັອບ
- ຂໍ້ມູນກ່ຽວກັບອັດຕາການລອດຕາຍຂອງ isotope ໃນ ທຳ ມະຊາດ.
- ຂໍ້ມູນຂອງຫົວ ໜ່ວຍ ປະລໍາມະນູ ສຳ ລັບ isotopes.



