ກະວີ:
Frank Hunt
ວັນທີຂອງການສ້າງ:
13 ດົນໆ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
ເນື້ອຫາ
- ເພື່ອກ້າວ
- ວິທີທີ່ 1 ຂອງ 3: ການໃຊ້ pH meter
- ວິທີທີ່ 2 ຂອງ 3: ດ້ວຍເຈ້ຍ litmus
- ວິທີທີ່ 3 ຂອງ 3: ເຂົ້າໃຈ pH
ມັນເປັນສິ່ງ ສຳ ຄັນທີ່ຈະວັດແທກລະດັບ pH - ລະດັບຂອງຄວາມເປັນກົດຫລືຄວາມເປັນດ່າງ - ຂອງນ້ ຳ. ນ້ ຳ ໃຊ້ພືດແລະສັດທີ່ພວກເຮົາເພິ່ງພາອາໃສ, ແລະພວກເຮົາດື່ມມັນທຸກໆມື້. ມູນຄ່າ pH ຂອງນໍ້າສາມາດເປັນຕົວຊີ້ບອກເຖິງການປົນເປື້ອນທີ່ເປັນໄປໄດ້, ສະນັ້ນການວັດແທກ pH ຂອງນໍ້າສາມາດເປັນການລະມັດລະວັງດ້ານສຸຂະພາບຂອງປະຊາຊົນທີ່ ສຳ ຄັນ.
ເພື່ອກ້າວ
ວິທີທີ່ 1 ຂອງ 3: ການໃຊ້ pH meter
 ປັບການກວດສອບແລະວັດແທກຕາມ ຄຳ ແນະ ນຳ ຂອງໂຮງງານ. ທ່ານອາດຈະ ຈຳ ເປັນຕ້ອງວັດແທກວັດແທກໂດຍໃຊ້ສານທີ່ມີຄ່າ pH ທີ່ຮູ້ຈັກ. ແມັດສາມາດປັບໄດ້ຕາມວັດຖຸນັ້ນ. ຖ້າທ່ານ ກຳ ລັງທົດສອບນ້ ຳ ຢູ່ນອກຫ້ອງທົດລອງ, ແນະ ນຳ ໃຫ້ທ່ານປະຕິບັດການວັດແທກນີ້ສອງສາມຊົ່ວໂມງກ່ອນການທົດສອບພາກສະ ໜາມ.
ປັບການກວດສອບແລະວັດແທກຕາມ ຄຳ ແນະ ນຳ ຂອງໂຮງງານ. ທ່ານອາດຈະ ຈຳ ເປັນຕ້ອງວັດແທກວັດແທກໂດຍໃຊ້ສານທີ່ມີຄ່າ pH ທີ່ຮູ້ຈັກ. ແມັດສາມາດປັບໄດ້ຕາມວັດຖຸນັ້ນ. ຖ້າທ່ານ ກຳ ລັງທົດສອບນ້ ຳ ຢູ່ນອກຫ້ອງທົດລອງ, ແນະ ນຳ ໃຫ້ທ່ານປະຕິບັດການວັດແທກນີ້ສອງສາມຊົ່ວໂມງກ່ອນການທົດສອບພາກສະ ໜາມ. - ລ້າງນໍ້າສະອາດກ່ອນທີ່ຈະ ນຳ ໃຊ້. ແຫ້ງດ້ວຍຜ້າທີ່ສະອາດ.
 ເອົາຕົວຢ່າງນໍ້າແລະຖອກລົງໃສ່ຖັງທີ່ສະອາດ.
ເອົາຕົວຢ່າງນໍ້າແລະຖອກລົງໃສ່ຖັງທີ່ສະອາດ.- ນ້ ຳ ຕ້ອງເລິກພຽງພໍທີ່ຈະຍ່ອຍປາຍໄຟຟ້າ.
- ປ່ອຍຕົວຢ່າງໄວ້ເປັນໄລຍະ ໜຶ່ງ ເພື່ອໃຫ້ອຸນຫະພູມຄົງຕົວ.
- ວັດອຸນຫະພູມຂອງຕົວຢ່າງດ້ວຍບາຫຼອດ.
 ປັບແມັດດ້ວຍອຸນຫະພູມຂອງຕົວຢ່າງ. ຄວາມອ່ອນໄຫວຂອງການກວດສອບແມ່ນໄດ້ຮັບຜົນກະທົບຈາກອຸນຫະພູມນ້ ຳ, ສະນັ້ນການວັດແທກສາມາດຖືກຕ້ອງຖ້າທ່ານໃສ່ຂໍ້ມູນອຸນຫະພູມ.
ປັບແມັດດ້ວຍອຸນຫະພູມຂອງຕົວຢ່າງ. ຄວາມອ່ອນໄຫວຂອງການກວດສອບແມ່ນໄດ້ຮັບຜົນກະທົບຈາກອຸນຫະພູມນ້ ຳ, ສະນັ້ນການວັດແທກສາມາດຖືກຕ້ອງຖ້າທ່ານໃສ່ຂໍ້ມູນອຸນຫະພູມ.  ວາງການກວດສອບໃນຕົວຢ່າງ. ລໍຖ້າໃຫ້ແມັດສາມາດບັນລຸຄວາມສົມດຸນ. ແມັດແມ່ນຢູ່ໃນສະຫມໍ່າສະເຫມີເມື່ອການອ່ານຄົງທີ່.
ວາງການກວດສອບໃນຕົວຢ່າງ. ລໍຖ້າໃຫ້ແມັດສາມາດບັນລຸຄວາມສົມດຸນ. ແມັດແມ່ນຢູ່ໃນສະຫມໍ່າສະເຫມີເມື່ອການອ່ານຄົງທີ່.  ອ່ານການວັດແທກ pH ຂອງຕົວຢ່າງ. ແມັດ pH ໃຫ້ຜົນໄດ້ຮັບໃນລະດັບ 0-14. ຖ້ານ້ ຳ ບໍລິສຸດ, ມູນຄ່າປະມານ 7. ຂຽນສິ່ງທີ່ຄົ້ນພົບຂອງທ່ານ.
ອ່ານການວັດແທກ pH ຂອງຕົວຢ່າງ. ແມັດ pH ໃຫ້ຜົນໄດ້ຮັບໃນລະດັບ 0-14. ຖ້ານ້ ຳ ບໍລິສຸດ, ມູນຄ່າປະມານ 7. ຂຽນສິ່ງທີ່ຄົ້ນພົບຂອງທ່ານ.
ວິທີທີ່ 2 ຂອງ 3: ດ້ວຍເຈ້ຍ litmus
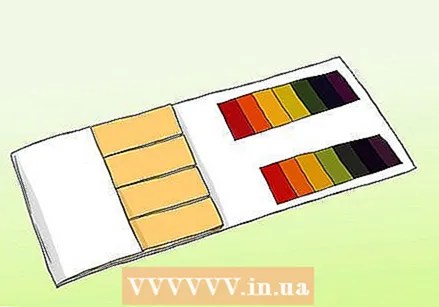 ຮຽນຮູ້ຄວາມແຕກຕ່າງລະຫວ່າງເຈ້ຍ pH ແລະເຈ້ຍ litmus. ທ່ານສາມາດໃຊ້ເຈ້ຍ pH ເພື່ອໃຫ້ໄດ້ອ່ານຕົວຢ່າງທີ່ຖືກຕ້ອງ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ເຈ້ຍ pH ບໍ່ຄວນສັບສົນກັບເຈ້ຍ litmus ປົກກະຕິ. ທັງສອງສາມາດຖືກ ນຳ ໃຊ້ເພື່ອທົດສອບທາດອາຊິດແລະຖານ, ແຕ່ມັນແຕກຕ່າງກັນໃນດ້ານທີ່ ສຳ ຄັນ.
ຮຽນຮູ້ຄວາມແຕກຕ່າງລະຫວ່າງເຈ້ຍ pH ແລະເຈ້ຍ litmus. ທ່ານສາມາດໃຊ້ເຈ້ຍ pH ເພື່ອໃຫ້ໄດ້ອ່ານຕົວຢ່າງທີ່ຖືກຕ້ອງ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ເຈ້ຍ pH ບໍ່ຄວນສັບສົນກັບເຈ້ຍ litmus ປົກກະຕິ. ທັງສອງສາມາດຖືກ ນຳ ໃຊ້ເພື່ອທົດສອບທາດອາຊິດແລະຖານ, ແຕ່ມັນແຕກຕ່າງກັນໃນດ້ານທີ່ ສຳ ຄັນ. - ເສັ້ນດ່າງ pH ມີຊຸດຂອງແຖບຕົວຊີ້ວັດທີ່ປ່ຽນສີໃນເວລາ ສຳ ຜັດກັບວິທີແກ້ໄຂ. ຄວາມເຂັ້ມແຂງຂອງອາຊິດແລະພື້ນຖານໃນແຕ່ລະແຖບແຕກຕ່າງກັນ. ຫຼັງຈາກການປ່ຽນແປງ, ຮູບແບບສີສາມາດຖືກປຽບທຽບກັບຕົວຢ່າງທີ່ສະ ໜອງ ໃຫ້ກັບຊຸດ.
- ເຈ້ຍ Litmus ແມ່ນແຖບເຈ້ຍທີ່ປະກອບດ້ວຍກົດຫລືຖານ (ເປັນດ່າງ). ເສັ້ນດ່າງທີ່ພົບເຫັນຫຼາຍທີ່ສຸດແມ່ນສີແດງ (ມີກົດທີ່ມີປະຕິກິລິຍາກັບຖານ) ແລະສີຟ້າ (ມີຖານທີ່ປະຕິກິລິຍາກັບອາຊິດ). ເສັ້ນດ່າງສີແດງປ່ຽນເປັນສີຟ້າຖ້າສານດັ່ງກ່າວເປັນດ່າງ, ແລະເສັ້ນດ່າງສີຟ້າກາຍເປັນສີແດງຖ້າສານດັ່ງກ່າວເປັນກົດ. ເອກະສານ Litmus ສາມາດ ນຳ ໃຊ້ເປັນການທົດສອບທີ່ລວດໄວແລະງ່າຍດາຍ, ແຕ່ແນວພັນທີ່ລາຄາຖືກທີ່ສຸດບໍ່ໄດ້ໃຫ້ມາດຕະການທີ່ຖືກຕ້ອງກ່ຽວກັບຄວາມເຂັ້ມແຂງຂອງການແກ້ໄຂ.
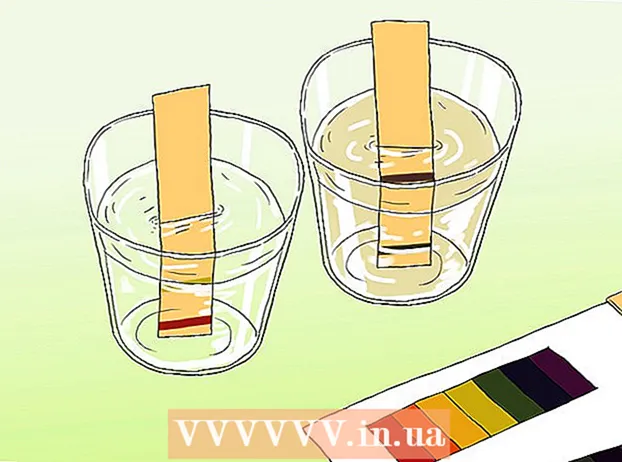
 ເອົາຕົວຢ່າງຂອງນ້ໍາແລະຖອກມັນເຂົ້າໄປໃນຖັງທີ່ສະອາດ. ນ້ ຳ ຕ້ອງເລິກພໍທີ່ຈະຈົມນ້ ຳ ອອກ.
ເອົາຕົວຢ່າງຂອງນ້ໍາແລະຖອກມັນເຂົ້າໄປໃນຖັງທີ່ສະອາດ. ນ້ ຳ ຕ້ອງເລິກພໍທີ່ຈະຈົມນ້ ຳ ອອກ.  ຈຸ່ມແຖບທົດສອບເຂົ້າໃນຕົວຢ່າງ. ການສະແດງອອກຂອງສອງສາມວິນາທີແມ່ນພຽງພໍ. ແຖບຕົວຊີ້ວັດຢູ່ເທິງເຈ້ຍຈະປ່ຽນສີພາຍຫຼັງບໍ່ເທົ່າໃດນາທີ.
ຈຸ່ມແຖບທົດສອບເຂົ້າໃນຕົວຢ່າງ. ການສະແດງອອກຂອງສອງສາມວິນາທີແມ່ນພຽງພໍ. ແຖບຕົວຊີ້ວັດຢູ່ເທິງເຈ້ຍຈະປ່ຽນສີພາຍຫຼັງບໍ່ເທົ່າໃດນາທີ.  ປຽບທຽບປາຍຂອງແຖບທົດສອບກັບຕາຕະລາງສີທີ່ມາພ້ອມກັບເຈ້ຍ. ສີຫຼືສີໃນບັດຕ້ອງກົງກັບສີຫລືສີທີ່ຢູ່ໃນແຖບທົດສອບ. ແຜນທີ່ສີຫຼັງຈາກນັ້ນກ່ຽວຂ້ອງກັບຮູບແບບສີໃນລະດັບ pH.
ປຽບທຽບປາຍຂອງແຖບທົດສອບກັບຕາຕະລາງສີທີ່ມາພ້ອມກັບເຈ້ຍ. ສີຫຼືສີໃນບັດຕ້ອງກົງກັບສີຫລືສີທີ່ຢູ່ໃນແຖບທົດສອບ. ແຜນທີ່ສີຫຼັງຈາກນັ້ນກ່ຽວຂ້ອງກັບຮູບແບບສີໃນລະດັບ pH.
ວິທີທີ່ 3 ຂອງ 3: ເຂົ້າໃຈ pH
 ຮຽນຮູ້ວິທີການ ກຳ ນົດທາດອາຊິດແລະຖານ. ອາຊິດແລະຄວາມເປັນດ່າງ (ຄຳ ສັບທີ່ໃຊ້ໃນການອະທິບາຍຖານຂໍ້ມູນ) ທັງສອງໄດ້ຖືກ ກຳ ນົດໂດຍທາດຢູເຣນຽມທີ່ພວກເຂົາບໍລິຈາກຫລືຮັບເອົາ. ທາດກົດແມ່ນສານທີ່ບໍລິຈາກ (ຫຼື“ ບໍລິຈາກ”) ທາດໄອໂອດິນ, ແລະຖານແມ່ນສານທີ່ດູດຊຶມທາດໄອໂອດິນພິເສດ.
ຮຽນຮູ້ວິທີການ ກຳ ນົດທາດອາຊິດແລະຖານ. ອາຊິດແລະຄວາມເປັນດ່າງ (ຄຳ ສັບທີ່ໃຊ້ໃນການອະທິບາຍຖານຂໍ້ມູນ) ທັງສອງໄດ້ຖືກ ກຳ ນົດໂດຍທາດຢູເຣນຽມທີ່ພວກເຂົາບໍລິຈາກຫລືຮັບເອົາ. ທາດກົດແມ່ນສານທີ່ບໍລິຈາກ (ຫຼື“ ບໍລິຈາກ”) ທາດໄອໂອດິນ, ແລະຖານແມ່ນສານທີ່ດູດຊຶມທາດໄອໂອດິນພິເສດ.  ເຂົ້າໃຈລະດັບ pH. ເລກ pH ແມ່ນໃຊ້ໃນການວັດລະດັບຂອງທາດອາຊິດຫລືເປັນດ່າງຂອງສານລະລາຍໃນນໍ້າ. ນ້ ຳ ປົກກະຕິມີທາດໄອໂອໄຮໂດຣໄຊ (OH−) ແລະທາດໄຮໂດຣນຽມ (H3O +) ເທົ່າກັນ. ອັດຕາສ່ວນຂອງ hydroxide ແລະ ion hydronium ປ່ຽນແປງເມື່ອສານທີ່ເປັນກົດຫລືເປັນດ່າງຖືກເພີ່ມເຂົ້າໃນນໍ້າ.
ເຂົ້າໃຈລະດັບ pH. ເລກ pH ແມ່ນໃຊ້ໃນການວັດລະດັບຂອງທາດອາຊິດຫລືເປັນດ່າງຂອງສານລະລາຍໃນນໍ້າ. ນ້ ຳ ປົກກະຕິມີທາດໄອໂອໄຮໂດຣໄຊ (OH−) ແລະທາດໄຮໂດຣນຽມ (H3O +) ເທົ່າກັນ. ອັດຕາສ່ວນຂອງ hydroxide ແລະ ion hydronium ປ່ຽນແປງເມື່ອສານທີ່ເປັນກົດຫລືເປັນດ່າງຖືກເພີ່ມເຂົ້າໃນນໍ້າ. - ປົກກະຕິແລ້ວມັນຖືວ່າເປັນຂະ ໜາດ ທີ່ຕັ້ງແຕ່ 0 ເຖິງ 14 (ເຖິງແມ່ນວ່າສານອາດຈະຕົກຢູ່ນອກລະດັບນີ້ກໍ່ຕາມ). ສານທີ່ເປັນກາງໄດ້ຄະແນນປະມານ 7, ສານທີ່ເປັນກົດແມ່ນຢູ່ພາຍໃຕ້ 7 ແລະສານທີ່ເປັນດ່າງຢູ່ຂ້າງເທິງ 7.
- ຂະ ໜາດ pH ແມ່ນ logarithmic, ໝາຍ ຄວາມວ່າຄວາມແຕກຕ່າງຂອງຕົວເລກສະແດງໃຫ້ເຫັນຄວາມແຕກຕ່າງຂອງກົດເປັນກົດຫລືຄວາມເປັນກົດດ່າງ. ຕົວຢ່າງ: ສານທີ່ມີ pH 2 ແມ່ນກົດຫຼາຍກ່ວາທາດທີ່ມີ pH 3, ແລະ 100 ເທົ່າກົດ 100 ກ່ວາສານທີ່ມີ pH ຂອງ 4. ຂະ ໜາດ ເຮັດວຽກຄືກັນກັບສານທີ່ເປັນດ່າງ, ມີອັນໃດອັນ ໜຶ່ງ integer ຖືກສະແດງໃຫ້ເຫັນເຖິງຄວາມແຕກຕ່າງຂອງສິບເທົ່າ.
 ຮຽນຮູ້ເຫດຜົນທີ່ພວກເຮົາທົດສອບ pH ຂອງນ້ ຳ. ນ້ ຳ ບໍລິສຸດມີ pH 7, ແຕ່ວ່ານ້ ຳ ປະປາໂຮນລັງປົກກະຕິມີ pH ໃນລະຫວ່າງ 7,5 ແລະ 8.3. ນ້ ຳ ທີ່ມີກົດຫຼາຍ (ນ້ ຳ ທີ່ມີມູນຄ່າ pH ຕ່ ຳ) ມັກຈະລະລາຍສານເຄມີທີ່ເປັນພິດ. ສິ່ງເຫລົ່ານີ້ສາມາດເຮັດໃຫ້ນ້ ຳ ເປິເປື້ອນແລະເຮັດໃຫ້ດື່ມບໍ່ປອດໄພ.
ຮຽນຮູ້ເຫດຜົນທີ່ພວກເຮົາທົດສອບ pH ຂອງນ້ ຳ. ນ້ ຳ ບໍລິສຸດມີ pH 7, ແຕ່ວ່ານ້ ຳ ປະປາໂຮນລັງປົກກະຕິມີ pH ໃນລະຫວ່າງ 7,5 ແລະ 8.3. ນ້ ຳ ທີ່ມີກົດຫຼາຍ (ນ້ ຳ ທີ່ມີມູນຄ່າ pH ຕ່ ຳ) ມັກຈະລະລາຍສານເຄມີທີ່ເປັນພິດ. ສິ່ງເຫລົ່ານີ້ສາມາດເຮັດໃຫ້ນ້ ຳ ເປິເປື້ອນແລະເຮັດໃຫ້ດື່ມບໍ່ປອດໄພ. - ໂດຍທົ່ວໄປ, ມັນໄດ້ຖືກແນະນໍາໃຫ້ທົດສອບ pH ຢູ່ໃນສະຖານທີ່. ຖ້າທ່ານເອົາຕົວຢ່າງນ້ ຳ ສຳ ລັບການຄົ້ນຄ້ວາຫ້ອງທົດລອງ, ຄາບອນໄດອອກໄຊ (CO2) ຈາກອາກາດສາມາດລະລາຍໃນນ້ ຳ ໄດ້. ທາດຄາບອນໄດອັອກໄຊທີ່ລະລາຍປະຕິກິລິຍາກັບທາດໄອອອນໃນນ້ ຳ ແລະເພີ່ມຄວາມເປັນກົດໃນການແກ້ໄຂພື້ນຖານຫລືເປັນກາງ. ເພື່ອຫລີກລ້ຽງການປົນເປື້ອນຄາບອນໄດອອກໄຊ, ຄວນທົດສອບນ້ ຳ ພາຍໃນເວລາສອງຊົ່ວໂມງຂອງການເກັບ.