ກະວີ:
Helen Garcia
ວັນທີຂອງການສ້າງ:
17 ເດືອນເມສາ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024
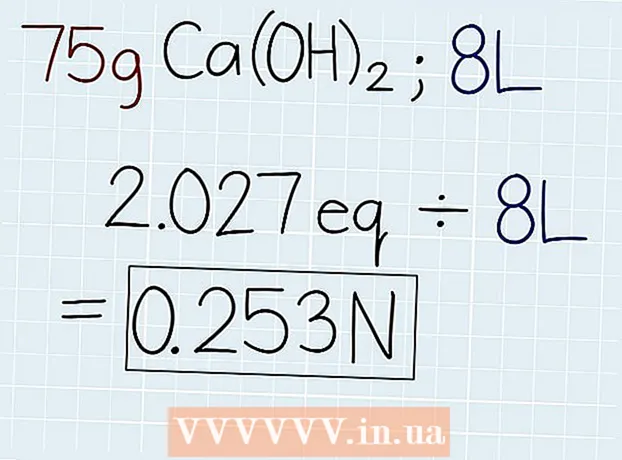
ເນື້ອຫາ
- ຂັ້ນຕອນ
- ວິທີທີ 1 ຈາກທັງ2ົດ 2: ການຄິດໄລ່ຄວາມເປັນປົກກະຕິຜ່ານທາງ Molarity
- ວິທີທີ່ 2 ຂອງ 2: ການຄິດໄລ່ຄວາມເປັນປົກກະຕິໃນມວນສານທຽບເທົ່າ
- ຄໍາແນະນໍາ
- ເຈົ້າຕ້ອງການຫຍັງ
ຄວາມເປັນປົກກະຕິສະແດງເຖິງຄວາມເຂັ້ມຂຸ້ນຂອງກົດຫຼືດ່າງໃນການແກ້ໄຂ. ເພື່ອຊອກຫາຄວາມເປັນປົກກະຕິຂອງການແກ້ໄຂ, ສາມາດໃຊ້ທັງທາດໂມເລກຸນແລະມະຫາຊົນທຽບເທົ່າຂອງໂມເລກຸນໃນການຄິດໄລ່. ຖ້າເຈົ້າເລືອກໃຊ້ molarity, ໃຊ້ສູດ N = M (n), ບ່ອນທີ່ M ແມ່ນ molarity ແລະ n ແມ່ນຈໍານວນໂມເລກຸນໄຮໂດຣເຈນຫຼືໄຮໂດຣໄຊດ. ຖ້າເຈົ້າຕັດສິນໃຈໃຊ້ມະຫາຊົນທຽບເທົ່າ, ໃຊ້ສູດ N = eq ÷ V, ບ່ອນທີ່ eq ແມ່ນຈໍານວນຂອງການທຽບເທົ່າແລະ V ແມ່ນປະລິມານຂອງການແກ້ໄຂ.
ຂັ້ນຕອນ
ວິທີທີ 1 ຈາກທັງ2ົດ 2: ການຄິດໄລ່ຄວາມເປັນປົກກະຕິຜ່ານທາງ Molarity
 1 ເພີ່ມປະລິມານ molar ຂອງສ່ວນປະກອບທັງofົດຂອງການແກ້ໄຂ. ຊອກຫາອົງປະກອບຂອງສູດເຄມີຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະເພື່ອຊອກຫາມວນສານປະລໍາມະນູຂອງພວກມັນ, ເຊິ່ງກົງກັບມະຫາຊົນຂອງ molar. ຂຽນມວນມະຫາຊົນຂອງແຕ່ລະອົງປະກອບແລະຄູນມັນດ້ວຍ ຈຳ ນວນຂອງອົງປະກອບເຫຼົ່ານັ້ນ. ເພີ່ມປະລິມານ molar ຂອງສ່ວນປະກອບທັງtoົດເພື່ອຊອກຫາມະຫາຊົນຂອງ molar ທັງົດ.
1 ເພີ່ມປະລິມານ molar ຂອງສ່ວນປະກອບທັງofົດຂອງການແກ້ໄຂ. ຊອກຫາອົງປະກອບຂອງສູດເຄມີຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະເພື່ອຊອກຫາມວນສານປະລໍາມະນູຂອງພວກມັນ, ເຊິ່ງກົງກັບມະຫາຊົນຂອງ molar. ຂຽນມວນມະຫາຊົນຂອງແຕ່ລະອົງປະກອບແລະຄູນມັນດ້ວຍ ຈຳ ນວນຂອງອົງປະກອບເຫຼົ່ານັ້ນ. ເພີ່ມປະລິມານ molar ຂອງສ່ວນປະກອບທັງtoົດເພື່ອຊອກຫາມະຫາຊົນຂອງ molar ທັງົດ. - ຕົວຢ່າງ, ຖ້າເຈົ້າຢາກຮູ້ວ່າມວນສານໂມເລກຸນຂອງອາຊິດຊູນຟູຣິກ (H2ດັ່ງນັ້ນ4), ຊອກຫາທາດໂມເລກຸນຂອງທາດໄຮໂດເຈນ (1 ກຼາມ), ກໍາມະຖັນ (3 ກ) ແລະອົກຊີ (16 ກຣາມ).
- ຄູນມວນຊົນດ້ວຍ ຈຳ ນວນຂອງສ່ວນປະກອບໃນອົງປະກອບ. ໃນຕົວຢ່າງຂອງພວກເຮົາ, ມີ 2 ປະລໍາມະນູໄຮໂດເຈນແລະ 4 ປະລໍາມະນູອົກຊີ. ມວນສານໂມເລກຸນທັງofົດຂອງໄຮໂດເຈນແມ່ນ 2 x 1 g = 2 g. ມວນສານໂມເລກຸນຂອງອົກຊີໃນການແກ້ໄຂບັນຫານີ້ຈະມີ 4 x 16 g = 64 g.
- ເພີ່ມມະຫາຊົນ molar ທັງtogetherົດເຂົ້າກັນ. ເຈົ້າໄດ້ຮັບ 2 g + 32 g + 64 g = 98 g / mol.
- ຖ້າເຈົ້າຮູ້ຄວາມແຕກຕ່າງຂອງການແກ້ໄຂທີ່ເຈົ້າກໍາລັງຊອກຫາຢູ່, ໄປຫາຂັ້ນຕອນທີ 4 ໂດຍກົງ.
 2 ຫານມະຫາຊົນຂອງການແກ້ໄຂບັນຫາດ້ວຍມວນມະຫາຊົນ. ຊອກຫານໍ້າ ໜັກ ຕົວຈິງຂອງການແກ້ໄຂ. ມັນຈະຖືກຊີ້ບອກບໍ່ວ່າຈະຢູ່ໃນພາຊະນະທີ່ມີການແກ້ໄຂບັນຫາ, ຫຼືໃນ ໜ້າ ວຽກເອງ.ຈາກນັ້ນແບ່ງມະຫາຊົນຂອງການແກ້ໄຂບັນຫາໂດຍມະຫາຊົນ molar ທັງfoundົດທີ່ພົບກ່ອນ ໜ້າ ນີ້. ຜົນໄດ້ຮັບຈະເປັນຈໍານວນຂອງ moles ໃນການແກ້ໄຂ, ຫຼັງຈາກນັ້ນຄວນຂຽນ“ mole”.
2 ຫານມະຫາຊົນຂອງການແກ້ໄຂບັນຫາດ້ວຍມວນມະຫາຊົນ. ຊອກຫານໍ້າ ໜັກ ຕົວຈິງຂອງການແກ້ໄຂ. ມັນຈະຖືກຊີ້ບອກບໍ່ວ່າຈະຢູ່ໃນພາຊະນະທີ່ມີການແກ້ໄຂບັນຫາ, ຫຼືໃນ ໜ້າ ວຽກເອງ.ຈາກນັ້ນແບ່ງມະຫາຊົນຂອງການແກ້ໄຂບັນຫາໂດຍມະຫາຊົນ molar ທັງfoundົດທີ່ພົບກ່ອນ ໜ້າ ນີ້. ຜົນໄດ້ຮັບຈະເປັນຈໍານວນຂອງ moles ໃນການແກ້ໄຂ, ຫຼັງຈາກນັ້ນຄວນຂຽນ“ mole”. - ຕົວຢ່າງ, ຖ້າເຈົ້າກໍາລັງພະຍາຍາມຊອກຫາຄວາມເປັນປົກກະຕິຂອງ 100 g H2ດັ່ງນັ້ນ4ລະລາຍໃນນໍ້າ 12 ລິດ, ໃຊ້ມະຫາຊົນຕົວຈິງແລະຫານດ້ວຍ molar. ຜົນທີ່ໄດ້ຮັບ, ເຈົ້າຈະໄດ້ຮັບ: 100 g ÷ 98 g / mol = 1.02 mol.
- 1 ໂມເລກຸນເທົ່າກັບ 6.02 x 10 ປະລໍາມະນູຫຼືໂມເລກຸນຂອງທາດລະລາຍ.
 3 ແບ່ງຜົນໄດ້ຮັບໂດຍປະລິມານຂອງວິທີແກ້ໄຂເປັນລິດເພື່ອຊອກຫາຄວາມລະລາຍ. ເອົາຕົວເລກຂອງໂມເລກຸນໃນການແກ້ໄຂພຽງແຕ່ຄິດໄລ່ແລະແບ່ງມັນດ້ວຍປະລິມານທັງofົດຂອງວິທີແກ້ໄຂທີ່ຈະວັດແທກ. ດ້ວຍເຫດນັ້ນ, ເຈົ້າຈະຮູ້ຄວາມລະລາຍ (M), ເຊິ່ງເຈົ້າສາມາດຊອກຫາຄວາມເຂັ້ມຂົ້ນຂອງການແກ້ໄຂ.
3 ແບ່ງຜົນໄດ້ຮັບໂດຍປະລິມານຂອງວິທີແກ້ໄຂເປັນລິດເພື່ອຊອກຫາຄວາມລະລາຍ. ເອົາຕົວເລກຂອງໂມເລກຸນໃນການແກ້ໄຂພຽງແຕ່ຄິດໄລ່ແລະແບ່ງມັນດ້ວຍປະລິມານທັງofົດຂອງວິທີແກ້ໄຂທີ່ຈະວັດແທກ. ດ້ວຍເຫດນັ້ນ, ເຈົ້າຈະຮູ້ຄວາມລະລາຍ (M), ເຊິ່ງເຈົ້າສາມາດຊອກຫາຄວາມເຂັ້ມຂົ້ນຂອງການແກ້ໄຂ. - ອີງຕາມຕົວຢ່າງຂອງພວກເຮົາ, ພວກເຮົາໄດ້ຮັບສູດດັ່ງຕໍ່ໄປນີ້: 1.02 mol ÷ 12 L = 0.085 M.
ຄໍາແນະນໍາ: ໃຫ້ແນ່ໃຈວ່າໄດ້ປ່ຽນປະລິມານຂອງວິທີແກ້ໄຂເປັນລິດ, ຖ້າເຈົ້າຍັງບໍ່ໄດ້ເຮັດເທື່ອ. ຖ້າບໍ່ດັ່ງນັ້ນ, ເຈົ້າຈະໄດ້ຮັບຄໍາຕອບຜິດ.
 4 ຄູນ molarity ດ້ວຍ ຈຳ ນວນໂມເລກຸນໄຮໂດເຈນຫຼືໄຮໂດຣໄຊ. ພິຈາລະນາເບິ່ງສູດເຄມີເພື່ອຊອກຫາຈໍານວນຂອງປະລໍາມະນູໄຮໂດຣເຈນ (H) ໃນໂມເລກຸນຂອງກົດຫຼື hydroxide ໃນ (OH) ໃນຖານ. ຫຼັງຈາກນັ້ນ, ຄູນ molarity ຂອງການແກ້ໄຂດ້ວຍຈໍານວນໂມເລກຸນໄຮໂດເຈນຫຼື hydroxide ໃນການແກ້ໄຂນັ້ນເພື່ອຊອກຫາຄວາມເຂັ້ມຂຸ້ນປົກກະຕິຫຼືຄວາມເປັນປົກກະຕິ. ໃນຕອນທ້າຍຂອງຄໍາຕອບຂອງເຈົ້າ, ຂຽນຕົວຫຍໍ້ "N".
4 ຄູນ molarity ດ້ວຍ ຈຳ ນວນໂມເລກຸນໄຮໂດເຈນຫຼືໄຮໂດຣໄຊ. ພິຈາລະນາເບິ່ງສູດເຄມີເພື່ອຊອກຫາຈໍານວນຂອງປະລໍາມະນູໄຮໂດຣເຈນ (H) ໃນໂມເລກຸນຂອງກົດຫຼື hydroxide ໃນ (OH) ໃນຖານ. ຫຼັງຈາກນັ້ນ, ຄູນ molarity ຂອງການແກ້ໄຂດ້ວຍຈໍານວນໂມເລກຸນໄຮໂດເຈນຫຼື hydroxide ໃນການແກ້ໄຂນັ້ນເພື່ອຊອກຫາຄວາມເຂັ້ມຂຸ້ນປົກກະຕິຫຼືຄວາມເປັນປົກກະຕິ. ໃນຕອນທ້າຍຂອງຄໍາຕອບຂອງເຈົ້າ, ຂຽນຕົວຫຍໍ້ "N". - ໃນຕົວຢ່າງຂອງພວກເຮົາ, ອາຊິດຊູນຟູຣິກ (H.2ດັ່ງນັ້ນ4) 2 ປະລໍາມະນູໄຮໂດເຈນ. ດັ່ງນັ້ນສູດຈະເປັນດັ່ງນີ້: 0.085 M x 2 = 0.17 N.
- ໃນຕົວຢ່າງອື່ນ, sodium hydroxide (NaOH) ທີ່ມີ molarity ຂອງ 2 M ມີໂມເລກຸນ hydroxide ພຽງແຕ່ 1. ດັ່ງນັ້ນ, ສູດຈະເປັນດັ່ງນີ້: 2 M x 1 = 2 N.
ວິທີທີ່ 2 ຂອງ 2: ການຄິດໄລ່ຄວາມເປັນປົກກະຕິໃນມວນສານທຽບເທົ່າ
 1 ຊອກຫາມະຫາຊົນ molar ທັງofົດຂອງການແກ້ໄຂ. ກວດເບິ່ງສູດເຄມີຂອງການແກ້ໄຂແລະຊອກຫາແຕ່ລະອົງປະກອບຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ. ຂຽນມວນມະຫາຊົນຂອງແຕ່ລະອົງປະກອບແລະຄູນມັນດ້ວຍ ຈຳ ນວນຂອງອົງປະກອບເຫຼົ່ານັ້ນໃນສູດ. ເພີ່ມມວນໂມເລກຸນທັງtogetherົດເຂົ້າກັນເພື່ອຊອກຫາມວນສານໂມເລກຸນທັງinົດເປັນກຼາມ.
1 ຊອກຫາມະຫາຊົນ molar ທັງofົດຂອງການແກ້ໄຂ. ກວດເບິ່ງສູດເຄມີຂອງການແກ້ໄຂແລະຊອກຫາແຕ່ລະອົງປະກອບຢູ່ໃນຕາຕະລາງແຕ່ລະໄລຍະ. ຂຽນມວນມະຫາຊົນຂອງແຕ່ລະອົງປະກອບແລະຄູນມັນດ້ວຍ ຈຳ ນວນຂອງອົງປະກອບເຫຼົ່ານັ້ນໃນສູດ. ເພີ່ມມວນໂມເລກຸນທັງtogetherົດເຂົ້າກັນເພື່ອຊອກຫາມວນສານໂມເລກຸນທັງinົດເປັນກຼາມ. - ຕົວຢ່າງ, ຖ້າເຈົ້າຢາກຮູ້ວ່າມະຫາຊົນຂອງ molar ຂອງ Ca (OH)2, ຈາກນັ້ນຊອກຫາທາດໂມເລກຸນຂອງທາດການຊຽມ (40 g), ອົກຊີແຊນ (16 g) ແລະ hydrogen (1 g).
- ໃນສູດມີ 2 ປະລໍາມະນູຂອງອົກຊີແລະໄຮໂດເຈນ. ມວນອົກຊີທັງwillົດຈະ: 2 x 16 g = 32 g. ມວນສານໂມເລກຸນຂອງໄຮໂດເຈນຈະ: 2 x 1 g = 2 g.
- ເພີ່ມມວນໂມເລກຸນທັງtogetherົດເຂົ້າກັນເພື່ອໃຫ້ໄດ້ 40 ກຣາມ + 32 ກຣາມ + 2 ກຼາມ = 74 ກຼາມ / mol.
 2 ຫານມວນໂມເລກຸນດ້ວຍ ຈຳ ນວນໂມເລກຸນໄຮໂດຣເຈນຫຼືໄຮໂດຣໄຊໄຊ. ຊອກຫາຈໍານວນຂອງປະລໍາມະນູໄຮໂດຣເຈນ (H) ໃນໂມເລກຸນຂອງກົດຫຼື hydroxide (OH) ຢູ່ໃນຖານ. ຫານມວນໂມເລກຸນທັງjustົດທີ່ຫາໄດ້ພຽງແຕ່ ຈຳ ນວນອະຕອມຫຼືໂມເລກຸນເພື່ອຊອກຫານໍ້າ ໜັກ ຂອງ 1 ທຽບເທົ່າ, ເຊິ່ງຈະເທົ່າກັບມວນທາດໂມເລກຸນໄຮໂດຣເຈນຫຼືໄຮໂດຣໄຊດ mole 1 ໂມເລກຸນ. ໃນຕອນທ້າຍຂອງຄໍາຕອບ, ຂຽນຕົວຫຍໍ້ "G.-e. " meaningາຍເຖິງມວນຂອງທຽບເທົ່າ.
2 ຫານມວນໂມເລກຸນດ້ວຍ ຈຳ ນວນໂມເລກຸນໄຮໂດຣເຈນຫຼືໄຮໂດຣໄຊໄຊ. ຊອກຫາຈໍານວນຂອງປະລໍາມະນູໄຮໂດຣເຈນ (H) ໃນໂມເລກຸນຂອງກົດຫຼື hydroxide (OH) ຢູ່ໃນຖານ. ຫານມວນໂມເລກຸນທັງjustົດທີ່ຫາໄດ້ພຽງແຕ່ ຈຳ ນວນອະຕອມຫຼືໂມເລກຸນເພື່ອຊອກຫານໍ້າ ໜັກ ຂອງ 1 ທຽບເທົ່າ, ເຊິ່ງຈະເທົ່າກັບມວນທາດໂມເລກຸນໄຮໂດຣເຈນຫຼືໄຮໂດຣໄຊດ mole 1 ໂມເລກຸນ. ໃນຕອນທ້າຍຂອງຄໍາຕອບ, ຂຽນຕົວຫຍໍ້ "G.-e. " meaningາຍເຖິງມວນຂອງທຽບເທົ່າ. - ໃນຕົວຢ່າງຂອງພວກເຮົາ, Ca (OH)2 2 ໂມເລກຸນໄຮໂດເຈນສອງອັນ, ຊຶ່ງmeansາຍຄວາມວ່າມວນສານຂອງທາດມູນຄ່າຈະເທົ່າກັບ 74 g / mol 2 = 37 G.-e.
 3 ແບ່ງນ້ ຳ ໜັກ ຕົວຈິງຂອງການແກ້ໄຂບັນຫານ້ ຳ ໜັກ ທຽບເທົ່າ. ຫຼັງຈາກທີ່ເຈົ້າຮູ້ຈັກມວນສານທຽບເທົ່າ, ແບ່ງມັນດ້ວຍມວນຂອງການແກ້ໄຂ, ເຊິ່ງຊີ້ບອກຢູ່ເທິງຖັງພ້ອມກັບວິທີແກ້ໄຂຫຼືໃນບັນຫາທີ່ກໍາລັງແກ້ໄຂ. ຄໍາຕອບຈະເປັນຈໍານວນຂອງການທຽບເທົ່າໃນການແກ້ໄຂເພື່ອວ່າຈາກນັ້ນເຈົ້າສາມາດຄິດໄລ່ຄວາມເປັນປົກກະຕິໄດ້. ໃນຕອນທ້າຍຂອງຄໍາຕອບ, ໃສ່ຕົວຫຍໍ້ "e."
3 ແບ່ງນ້ ຳ ໜັກ ຕົວຈິງຂອງການແກ້ໄຂບັນຫານ້ ຳ ໜັກ ທຽບເທົ່າ. ຫຼັງຈາກທີ່ເຈົ້າຮູ້ຈັກມວນສານທຽບເທົ່າ, ແບ່ງມັນດ້ວຍມວນຂອງການແກ້ໄຂ, ເຊິ່ງຊີ້ບອກຢູ່ເທິງຖັງພ້ອມກັບວິທີແກ້ໄຂຫຼືໃນບັນຫາທີ່ກໍາລັງແກ້ໄຂ. ຄໍາຕອບຈະເປັນຈໍານວນຂອງການທຽບເທົ່າໃນການແກ້ໄຂເພື່ອວ່າຈາກນັ້ນເຈົ້າສາມາດຄິດໄລ່ຄວາມເປັນປົກກະຕິໄດ້. ໃນຕອນທ້າຍຂອງຄໍາຕອບ, ໃສ່ຕົວຫຍໍ້ "e." - ຖ້າຢູ່ໃນຕົວຢ່າງຂອງພວກເຮົາ 75 g Ca (OH)2, ຈາກນັ້ນສູດຈະເປັນດັ່ງຕໍ່ໄປນີ້: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 ຫານ ຈຳ ນວນທີ່ທຽບເທົ່າດ້ວຍປະລິມານຂອງການແກ້ໄຂບັນຈຸເປັນລິດ. ຊອກຫາປະລິມານທັງofົດຂອງວິທີແກ້ໄຂແລະຂຽນ ຄຳ ຕອບລົງເປັນລິດ. ເອົາຕົວເລກທຽບເທົ່າທີ່ຫາກໍ່ໄດ້ມາແລະຫານດ້ວຍປະລິມານຂອງວິທີແກ້ໄຂບັນຫາເພື່ອຊອກຫາຄວາມເປັນປົກກະຕິ. ໃນຕອນທ້າຍຂອງ ຄຳ ຕອບຂອງເຈົ້າໃສ່ຕົວຫຍໍ້ "N".
4 ຫານ ຈຳ ນວນທີ່ທຽບເທົ່າດ້ວຍປະລິມານຂອງການແກ້ໄຂບັນຈຸເປັນລິດ. ຊອກຫາປະລິມານທັງofົດຂອງວິທີແກ້ໄຂແລະຂຽນ ຄຳ ຕອບລົງເປັນລິດ. ເອົາຕົວເລກທຽບເທົ່າທີ່ຫາກໍ່ໄດ້ມາແລະຫານດ້ວຍປະລິມານຂອງວິທີແກ້ໄຂບັນຫາເພື່ອຊອກຫາຄວາມເປັນປົກກະຕິ. ໃນຕອນທ້າຍຂອງ ຄຳ ຕອບຂອງເຈົ້າໃສ່ຕົວຫຍໍ້ "N". - ຖ້າມີ 75 g Ca (OH) ໃນການແກ້ໄຂບັນຈຸປະລິມານ 8 ລິດ2ຈາກນັ້ນ, ຫານຕົວເລກທຽບເທົ່າດ້ວຍປະລິມານຕາມວິທີດັ່ງນີ້: 2.027 Oe. ÷ 8 l = 0.253 ນ.
ຄໍາແນະນໍາ
- ຄວາມເຂັ້ມຂຸ້ນປົກກະຕິ, ຫຼືຄວາມເປັນປົກກະຕິ, ຖືກໃຊ້ທົ່ວໄປເພື່ອວັດແທກອາຊິດແລະຖານ. ຖ້າເຈົ້າຕ້ອງການກໍານົດຄວາມເຂັ້ມຂົ້ນຂອງວິທີແກ້ໄຂບັນຫາອື່ນ, ອັນນີ້ປົກກະຕິແລ້ວແມ່ນເຮັດໄດ້ໂດຍການວັດແທກຄວາມລະອຽດ.
ເຈົ້າຕ້ອງການຫຍັງ
- ຕາຕະລາງແຕ່ລະໄລຍະ
- ເຄື່ອງຄິດເລກ