ກະວີ:
Lewis Jackson
ວັນທີຂອງການສ້າງ:
5 ເດືອນພຶດສະພາ 2021
ວັນທີປັບປຸງ:
1 ເດືອນກໍລະກົດ 2024

ເນື້ອຫາ
Mol ແມ່ນຫົວ ໜ່ວຍ ມາດຕະຖານຂອງການວັດແທກໃນເຄມີສາດ, ໃຊ້ເພື່ອເບິ່ງອົງປະກອບທີ່ແຕກຕ່າງກັນໃນທາດປະສົມ. ໂດຍປົກກະຕິແລ້ວມວນສານປະສົມຖືກຄິດໄລ່ເປັນກຼາມ (g) ແລະ ຈຳ ເປັນຕ້ອງໄດ້ປ່ຽນເປັນຫົວ ໜ່ວຍ ໂມ້. ການຫັນປ່ຽນແມ່ນຂ້ອນຂ້າງງ່າຍດາຍ, ເຖິງຢ່າງໃດກໍ່ຕາມ, ມັນຍັງມີບາງບາດກ້າວທີ່ ສຳ ຄັນທີ່ພວກເຮົາຕ້ອງປະຕິບັດຕາມ. ໂດຍໃຊ້ວິທີການຂ້າງລຸ່ມນີ້, ທ່ານສາມາດປ່ຽນກຼາມໄປເປັນ moles ໄດ້ຢ່າງງ່າຍດາຍ.
ຂັ້ນຕອນ
ສ່ວນທີ 1 ຂອງ 2: ຄິດໄລ່ມວນໂມເລກຸນ
ກຽມເຄື່ອງໃຊ້ທີ່ ຈຳ ເປັນເພື່ອແກ້ໄຂບັນຫາເລກຄະນິດສາດ. ເມື່ອທ່ານມີເຄື່ອງມືທຸກຢ່າງ, ມັນຈະງ່າຍຕໍ່ການແກ້ໄຂບັນຫາ. ສິ່ງທີ່ທ່ານຕ້ອງການແມ່ນ:
- ດິນສໍແລະເຈ້ຍ. ຄະນິດສາດຈະງ່າຍຂື້ນເມື່ອທ່ານຂຽນທຸກຢ່າງໃສ່ເຈ້ຍ. ທ່ານ ຈຳ ເປັນຕ້ອງ ນຳ ສະ ເໜີ ທຸກບາດກ້າວເພື່ອໃຫ້ໄດ້ຄະແນນສູງສຸດ.
- ຕາຕະລາງແຕ່ລະໄລຍະຂອງອົງປະກອບເຄມີ: ໃຊ້ໃນການ ກຳ ນົດອະຕອມຂອງອົງປະກອບ.
- Pocket calculator: ໃຊ້ໃນການຄິດໄລ່ເລກທີ່ສັບສົນ.

ກໍານົດວ່າມີອົງປະກອບໃດແດ່ທີ່ຢູ່ໃນສານປະສົມທີ່ທ່ານຕ້ອງການທີ່ຈະປ່ຽນເປັນຫົວ ໜ່ວຍ ໂມ້. ຂັ້ນຕອນ ທຳ ອິດໃນການຄິດໄລ່ມວນໂມເລກຸນແມ່ນການ ກຳ ນົດອົງປະກອບທີ່ປະກອບເປັນທາດປະສົມ. ນີ້ແມ່ນງ່າຍເພາະວ່າການຍໍ້ ສຳ ລັບອົງປະກອບມີພຽງແຕ່ 1 ຫາ 2 ຕົວອັກສອນ.- ຖ້າສານໃດ ໜຶ່ງ ຖືກຫຍໍ້ດ້ວຍຕົວອັກສອນສອງຕົວ, ຕົວອັກສອນ ທຳ ອິດຈະເປັນຕົວແທນໃຫຍ່ແລະຕົວອັກສອນທີສອງແມ່ນຕົວອັກສອນນ້ອຍ. ຕົວຢ່າງ: Mg ແມ່ນຕົວຫຍໍ້ ສຳ ລັບທາດປະກອບແມກນີຊຽມ.
- ທາດປະສົມ NaHCO3 ປະກອບດ້ວຍສີ່ອົງປະກອບ: ໂຊດຽມ (ນາ), ໄຮໂດເຈນ (H), ກາກບອນ (C) ແລະອົກຊີເຈນ (O).
ກຳ ນົດ ຈຳ ນວນອະຕອມ ສຳ ລັບແຕ່ລະອົງປະກອບໃນສ່ວນປະສົມ. ທ່ານ ຈຳ ເປັນຕ້ອງຮູ້ ຈຳ ນວນປະລໍາມະນູຂອງແຕ່ລະສານໃນສານປະສົມເພື່ອຄິດໄລ່ໂມເລກຸນຂອງທາດປະສົມນັ້ນ. ຕົວເລກນ້ອຍໆທີ່ຢູ່ຕິດກັບຕົວຫຍໍ້ຂອງອົງປະກອບນັ້ນ ໝາຍ ເຖິງຕົວເລກປະລໍາມະນູຂອງອົງປະກອບ.- ຕົວຢ່າງ: ທາດປະສົມ H2O ມີສອງປະລໍາມະນູ hydrogen ແລະປະລໍາມະນູ oxygen ຫນຶ່ງ.
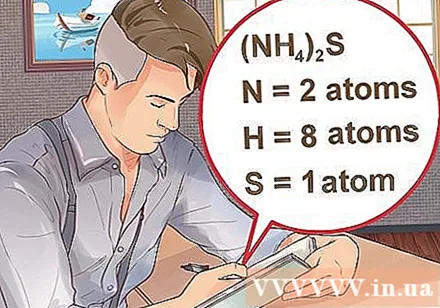
- ຖ້າສານປະສົມຖືກຂຽນໄວ້ໃນວົງເລັບ, ປະກອບດ້ວຍດັດຊະນີນ້ອຍໆ, ນັ້ນ ໝາຍ ຄວາມວ່າແຕ່ລະສ່ວນປະກອບໃນວົງເລັບຄູນດັດຊະນີ. ຕົວຢ່າງ: ທາດປະສົມ (NH4)2S ປະກອບດ້ວຍສອງປະລໍາມະນູ N, ແປດ H ປະລໍາມະນູແລະປະລໍາມະນູ S ຫນຶ່ງ.

ຂຽນເຈ້ຍປະລໍາມະນູກ້ອນສໍາລັບແຕ່ລະອົງປະກອບ. ການ ນຳ ໃຊ້ຕາຕະລາງແຕ່ລະໄລຍະແມ່ນວິທີທີ່ງ່າຍທີ່ສຸດໃນການຊອກຫາປະລິມານກ້ອນຂອງອົງປະກອບ ໜຶ່ງ. ຫຼັງຈາກທີ່ທ່ານຊອກຫາອົງປະກອບໃນຕາຕະລາງແຕ່ລະໄລຍະ, ທ່ານຈະເຫັນມວນມະຕພາບຢູ່ຂ້າງລຸ່ມໄອຄອນຂອງອົງປະກອບ.- ຕົວຢ່າງ, ປະລໍາມະນູຂອງອົກຊີເຈນແມ່ນ 15,99.
ຄິດໄລ່ມວນໂມເລກຸນ. ໂມເລກຸນມວນສານຂອງສານ ໜຶ່ງ ເທົ່າກັບ ຈຳ ນວນອະຕອມຂອງແຕ່ລະອົງປະກອບຄູນດ້ວຍອະຕອມມະຫາສານຂອງອົງປະກອບນັ້ນ. ປະລິມານນີ້ແມ່ນມີຄວາມ ຈຳ ເປັນໃນກຼາມເພື່ອການປ່ຽນຮູບໂມ້.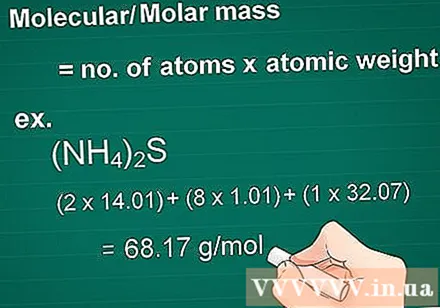
- ຫນ້າທໍາອິດ, ຄູນຈໍານວນປະລໍາມະນູຂອງແຕ່ລະອົງປະກອບໃນປະສົມໂດຍປະລໍາມະນູຂອງມັນ.
- ຈາກນັ້ນຕື່ມມວນສານຂອງອົງປະກອບຕ່າງໆທີ່ຢູ່ໃນສານປະສົມເຂົ້າກັນ.
- ຕົວຢ່າງ: ມະຫາຊົນໂມເລກຸນຂອງທາດປະສົມ (NH)4)2S = (2 x 14.01) + (8 x 1.01) + (1 x 32.07) = 68.17 g / mol.
- ມະຫາຊົນໂມເລກຸນຍັງເອີ້ນວ່າມະຫາຊົນໂມເລກຸນ.
ສ່ວນທີ 2 ຂອງ 2: ປ່ຽນກຼາມໄປເປັນມມ
ຕັ້ງສູດການແປງ. ເພື່ອຊອກຫາ ຈຳ ນວນຂອງສານປະສົມ, ແບ່ງ ຈຳ ນວນກຼາມຂອງທາດປະສົມໂດຍໂມໂມດຂອງທາດປະສົມນັ້ນ.
- ສູດ: ຈຳ ນວນຂອງ moles = ມວນ (ກຼາມ) / ມະຫາຊົນໂມເລກຸນຂອງສານປະສົມ (ກຣາມ / ໂມ)
ເອົາຕົວເລກເຂົ້າໃນສູດ. ຫຼັງຈາກການຕັ້ງສູດທີ່ຖືກຕ້ອງ, ຂັ້ນຕອນຕໍ່ໄປແມ່ນການທົດແທນຕົວເລກທີ່ທ່ານໄດ້ຄິດໄລ່ເຂົ້າໃນສູດ. ຖ້າທ່ານຕ້ອງການໃຫ້ແນ່ໃຈວ່າຂໍ້ມູນຢູ່ໃນ ຕຳ ແໜ່ງ ທີ່ຖືກຕ້ອງ, ທ່ານສາມາດກວດເບິ່ງມັນໂດຍການສະກັດກັ້ນ ໜ່ວຍ ງານ. ຖ້າຫາກວ່າຫຼັງຈາກຄວາມລຽບງ່າຍຫນ່ວຍທີ່ຍັງເຫຼືອແມ່ນ moles ຫຼັງຈາກນັ້ນທ່ານກໍ່ຖືກຕັ້ງຄ່າຢ່າງຖືກຕ້ອງ.
ແກ້ສົມຜົນ. ການ ນຳ ໃຊ້ເຄື່ອງຄິດໄລ່, ແບ່ງສ່ວນມວນໂດຍໂມເລກຸນກ້ອນຂອງທາດຫຼືທາດປະສົມ. ຈຳ ນວນຈະເປັນ ຈຳ ນວນຂອງສານຫຼືສານປະສົມທີ່ທ່ານ ກຳ ລັງຊອກຫາຢູ່.
- ຕົວຢ່າງ, ບັນຫາແມ່ນ ສຳ ລັບນ້ ຳ 2 g (H2O) ແລະຂໍໃຫ້ທ່ານປ່ຽນມັນໄປເປັນຫົວ ໜ່ວຍ ໂມ້. ພວກເຮົາມີມວນໂມໂມຂອງ H2O ແມ່ນ 18g / mol. ແບ່ງ 2 ໂດຍ 18, ດັ່ງນັ້ນທ່ານມີ 0.1111 mol H2O.
ຄຳ ແນະ ນຳ
- ຢ່າລືມໃສ່ຊື່ອົງປະກອບຫຼືຊື່ປະສົມກັບ ຄຳ ຕອບ.
- ຖ້າທ່ານຖືກຂໍໃຫ້ສະ ເໜີ ການອອກ ກຳ ລັງກາຍຫລືແບບສອບຖາມ, ໃຫ້ແນ່ໃຈວ່າທ່ານຈະສະແດງ ຄຳ ຕອບຂອງທ່ານຢ່າງຈະແຈ້ງໂດຍການຂີດວົງມົນຫລືແຕ້ມຮູບໃສ່ປ່ອງ ຄຳ ຕອບອ້ອມ ຄຳ ຕອບ.
ເຈົ້າຕ້ອງການຫັຍງ
- ຕາຕະລາງແຕ່ລະໄລຍະທາງເຄມີ
- ດິນສໍ
- ເຈ້ຍ
- ຄອມພິວເຕີ
- ປັນຫາເຄມີ



